药包材& 生产工艺系统相容性研究
业务范围
1、成品和原液药包材相容性研究,包括:西林瓶、安瓿瓶、胶塞、预灌封、滴眼剂瓶、塑料瓶、细胞冻存袋、塑料桶、不锈钢桶。
2、生产过程组件相容性研究,包括:硅胶管、过滤器、连接组件、玻璃组件、不锈钢组件、储液袋、搅拌袋。
3、医疗器械材料化学特性,包括气体管路测试、化学表征可沥滤物等材料化学特性研究。
4、给药器具相容性研究:包括输液器,注射器,留置针,一次性给药适配器等给药器的相容性研究。
英格尔优势
团队专业:成熟的相容性研究团队,超过数百例的项目研究经验,有各种品种的数据库积累,丰富的项目申报经验,熟悉USPEAMAPQRIBPOGICHISO 10993和国内的所有相关法规,结合最新国内政策及药学专家数年的研究经验来制定专属相容性研究方案方案设计符合NMPA、FDA EMEA等申报要求。
仪器一流:配置一整套最新、敏度高、带审计追踪功能的仪器设备(包括但不限于AB SCIEX LC-MS-MS、PerkinLmer ICP-MS/OES、安捷伦HPLC-FID/DAD、GC-MS-MS、HS-GC-MS等)
包材风险分类
|
不同给药途径的风险升级 |
制剂与包装组件发生相互作用的可能性 |
||
|
高 |
中 |
低 |
|
|
最高 |
吸入气雾剂及喷雾剂 |
注射液和注射用混悬液 吸入溶液剂 |
无菌粉末和注射用粉末 吸入粉雾剂 |
|
高 |
透皮软膏及贴剂 |
眼用溶液及混悬液 鼻用气雾剂及喷雾剂 |
|
|
低 |
局部用溶液及混悬液 局部及舌下用气雾剂 口服溶液及混悬1剂 |
口服片剂和口服(硬和软明胶)胶囊 局部用粉剂 口服散剂 |
|
药包材相容性流程研究
1. 信息的收集评估:
根据项目申请单的包装材料配方信息、生产工艺信息以及与药品有关的关键参数(如规格、给药途径、日最大摄入量等)为客户定制相容性研究方案。
2. 提取实验和模拟试验:
模拟、提取试验会充分考虑药品在生产、贮存、运输以及使用过程中可能面临的极端条件进行阈值的计算、模拟液和模拟条件的选择、以及对可提取物方法的开发,帮助客户筛选包材。
3. 方法学设计与验证:
根据中国药典、美国药典和国内相关指导原则,对检测方法进行方法学验证,内容包含但不限于专属性、线性、系统适用性、准确度、精密度(重复性和中间精密度)、检出限和定量限。
4. 浸出物(迁移)试验:
针对加速、长期稳定性样品的测试,根据NMPA药品研发试验记录规定规范原始数据管理。
5. 毒理学安全性评估:
参考毒理学数据库如DEREK, TOXNET, HSDB, TOXLINE等,由毒理学专家完成包括建模、数据库查询、文献查询、阈值计算等工作,从而得到完整的毒理学评估报告。
6. 结论:
综合可提取物研究和浸出物研究结果,并参考毒理学评估结果,给出最终的相容性研究结论。
参考的国内法规如下
《化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则(试行)》
《化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行)》
《化学药品注射剂与药用弹性体相容性研究技术指导原则(试行)》
《YBB00142002-2015药品包装材料与药物相容性试验指导原则》
《中国药典》2015版等
PQRI
ICH Q3D
USP 1663& USP1664
USP 665& USP 1665
常见问题
包装材料和药品种类多样、复杂法规要求理解不透彻,无法设计出一套完整的解决方案溶出量极低且体系复杂,仪器的高灵敏度和高选择性并重
英格尔,聚力价值信任
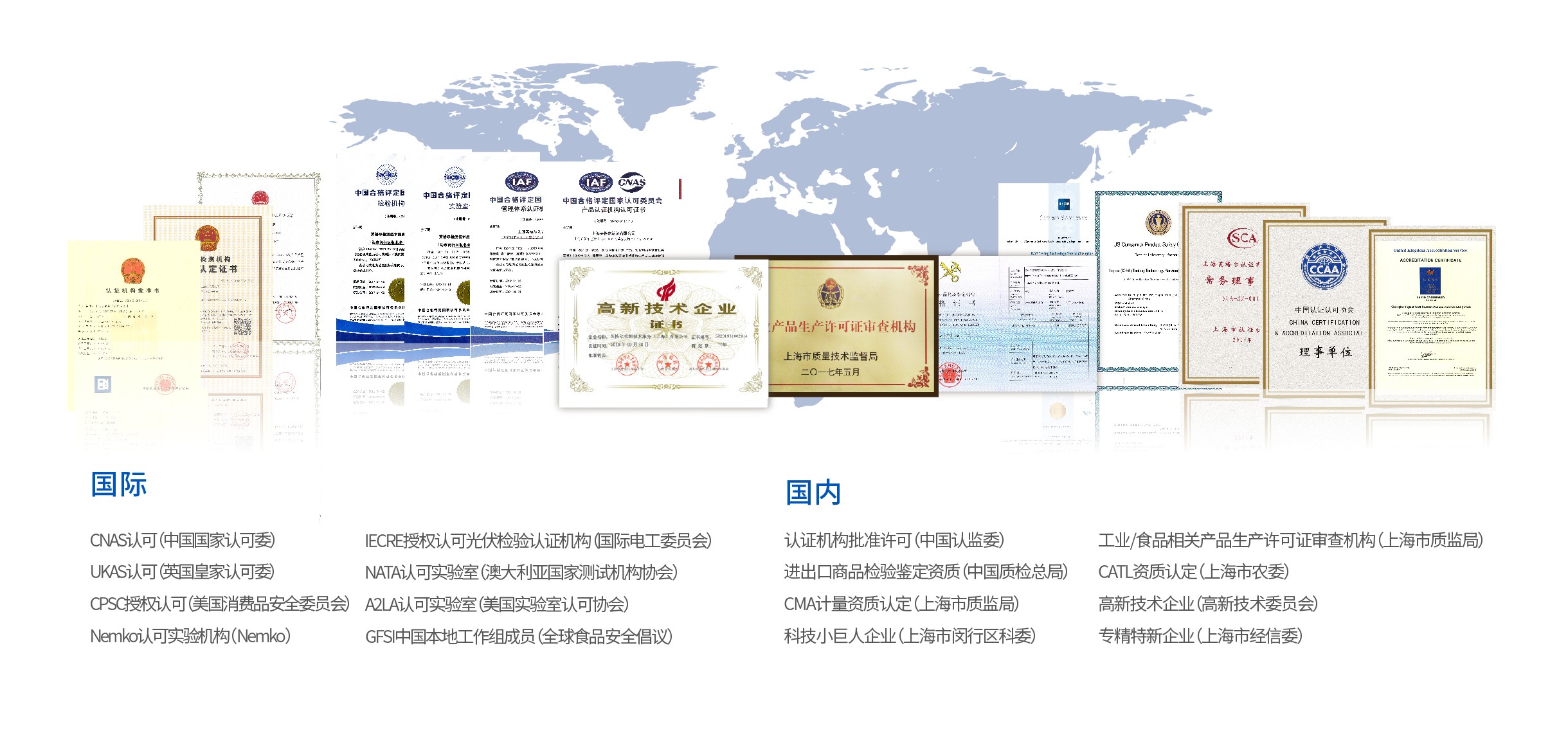
恪守全球标准规范
大型企业、政府机构、高效研发机构

一线品牌(沃特世、赛默飞、安捷伦、戴安等)高配实验室设备

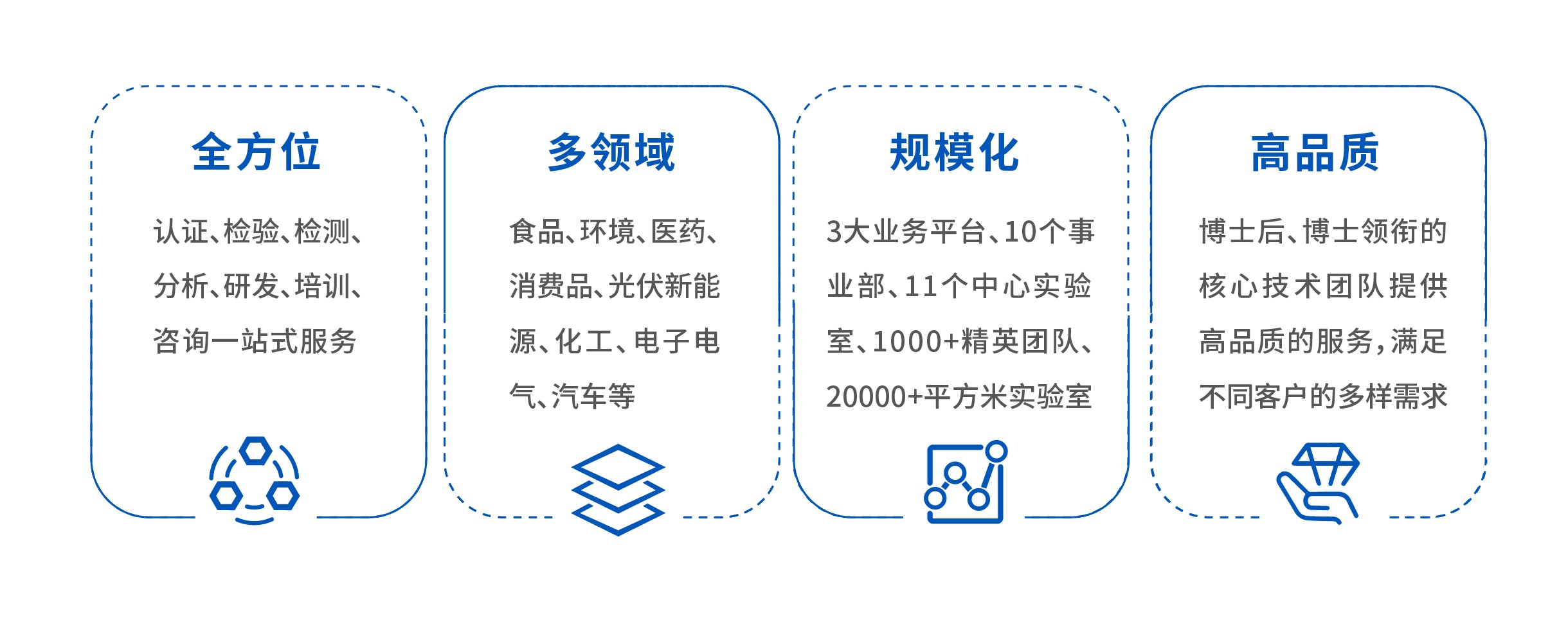
全方位的服务内容,多领域的服务能力,规模化的服务平台、高品质的服务质量