药物相容性指的是由于药物与所接触的材料、容器等发生作用而对药物的治疗而产生的相互影响,包括材料的可提取物、浸出物以及由于其相互作用给药品质量及使用功能带来的风险。一次性输注器具注册指导原则中要求对于预期用于输注药物的器具,企业需提交所输注药物与器具的相容性研究报告,至少应包括所申报的器具对所输注药物的吸附情况的实验研究的数据与结论。同时,提交国内外关于所申报器具对药物吸附情况的综述报告,对于首次用于医疗器械方面的新材料,应提供该材料适合用于人体的预期使用部位的相关研究资料。为确保符合要求,各公司对药物相容性的重视程度也越来越高。
第一步:药物选择依据
药物相容性试验中药物的选择主要是依据查阅文献,搜集临床试验数据和与同类材质的输注产品适用性进行对比,参考用药等信息获取。
第二步:样品准备
选取需要研究的同种产品中规格型号最复杂的型号作为试验样品的规格型号。
注:为避免试验出现偶发性结果,建议取不同时间生产的不同批次产品,共三批进行试验。
第三步:仪器、试剂、标准品
根据实验所涉及药物种类查询药典或文学资料,搜集测试所需要的仪器、试剂和标准品.
第五步:药物配制
上述表5中部分药物大容量规格的注射液按规定用量直接模拟滴注即可,另一部分药物需要根据药品说明书或查阅相关文献进行配制。
第六步:模拟滴注温度选择
根据《一次性使用避光输液器注册技术审查指导原则(征求意见稿)》“6.1.3一般相容性试验的要求:药物试验应考虑考察不同温度情况下药物溶液与输液器接触后的相互变化,通常考虑在常温(25℃±1℃)及40℃±1℃温度条件下试验。”本次试验也选用(25℃±1℃)及40℃±1℃温度条件下分别进行试验。
第七步:模拟滴注滴速选择
根据文献《药物输注速度的影响因素与用药安全》,临床一般静脉输液滴注60-80d/min,根据药品使用说明书用法用量、药品浓度、输液滴速,并考虑特殊药物如甲硝唑葡萄糖注射液、中药注射液滴速对患者的影响,从而确定输注滴速。详见附录1。
注:1、药品使用说明书有输注滴速要求的参照说明书进行,无规定的滴速要求按60-80d/min输注或依据文献。
2、体表面积:均按成人60kg,170cm计算为1.7m2
3、体重:均按成人60kg计算。
第八步:样品采集时间选择
根据药物的输注用量及时间要求,正常情况按一定的时间间隔进行样品采集(如:0h、0.5h、1h、1.5h、2h、3h、4h、5h、6h、8h),如没有达到8h滴注时间则在近结束前进行取样测定,详见附录1。
第九步:检测项目选择
本药物相容性验证共选用多种药物进行验证,其中有部分药物是不经稀释,直接进行验证试验,针对此类药物,各取样时间段样品按照相关标准进行逐项检测。另一部分按临床需要配制成不同浓度,因原药液被稀释,各取样时间段的样品不能按相关标准规定的指标进行全项检测;
具体检测项目可选:PH值、渗透压摩尔浓度比、含量、溶媒介质含量。
3、数据分析和结论
根据每种药物的检测项目不同时间段的检测结果进行对比分析,看实验结果的偏差是否在药典规定偏差范围内,根据不同时间段药物含量的变化趋势分析吸附随时间的变化形式,并且与PVC对比进行分析,以确定本次实验的产品输注以上药物是否安全。
英格尔,聚力价值信任
- 标准规范
|
- 合作伙伴
|
- 仪器设备
|
- 集团优势
恪守全球标准规范
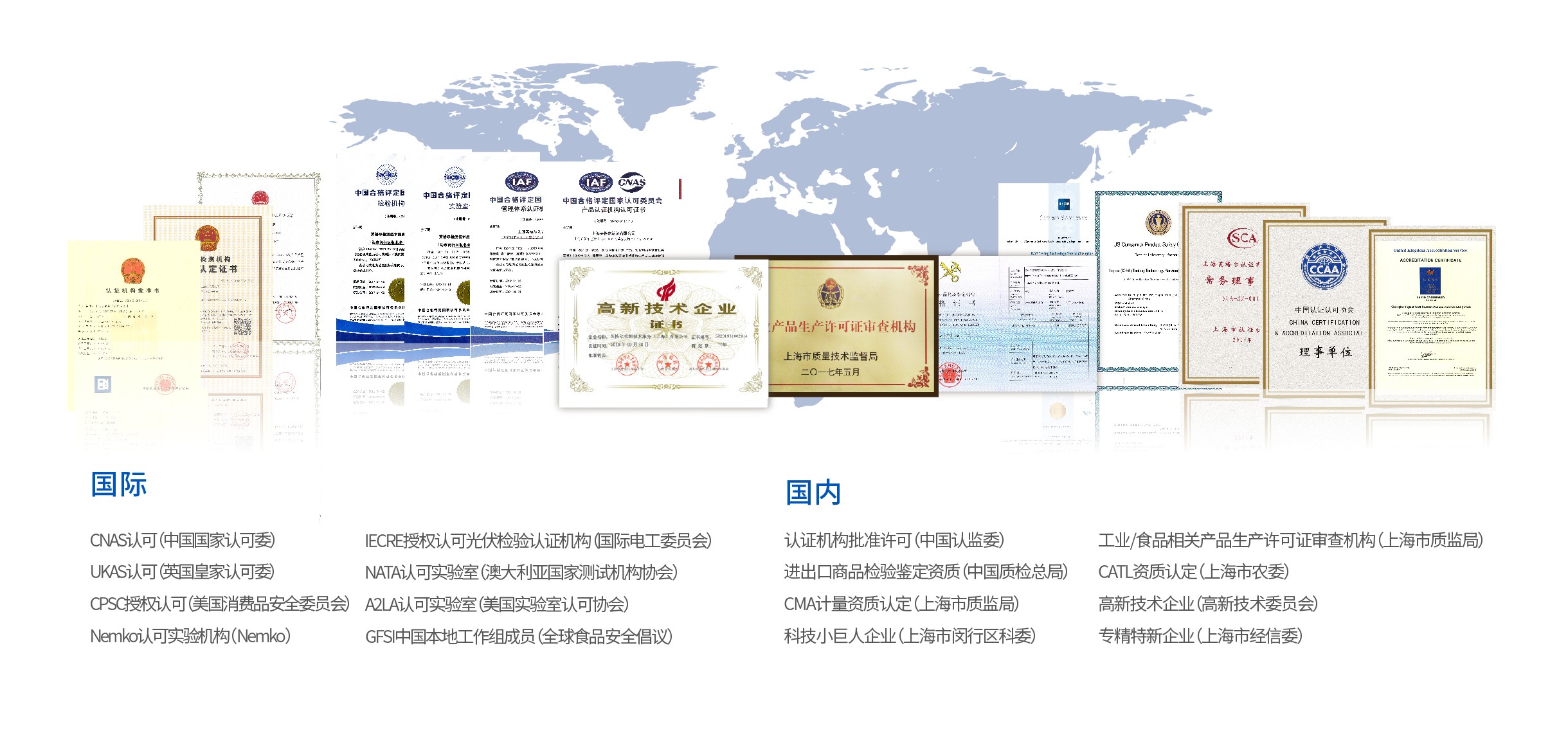
大型企业、政府机构、高效研发机构

一线品牌(沃特世、赛默飞、安捷伦、戴安等)高配实验室设备

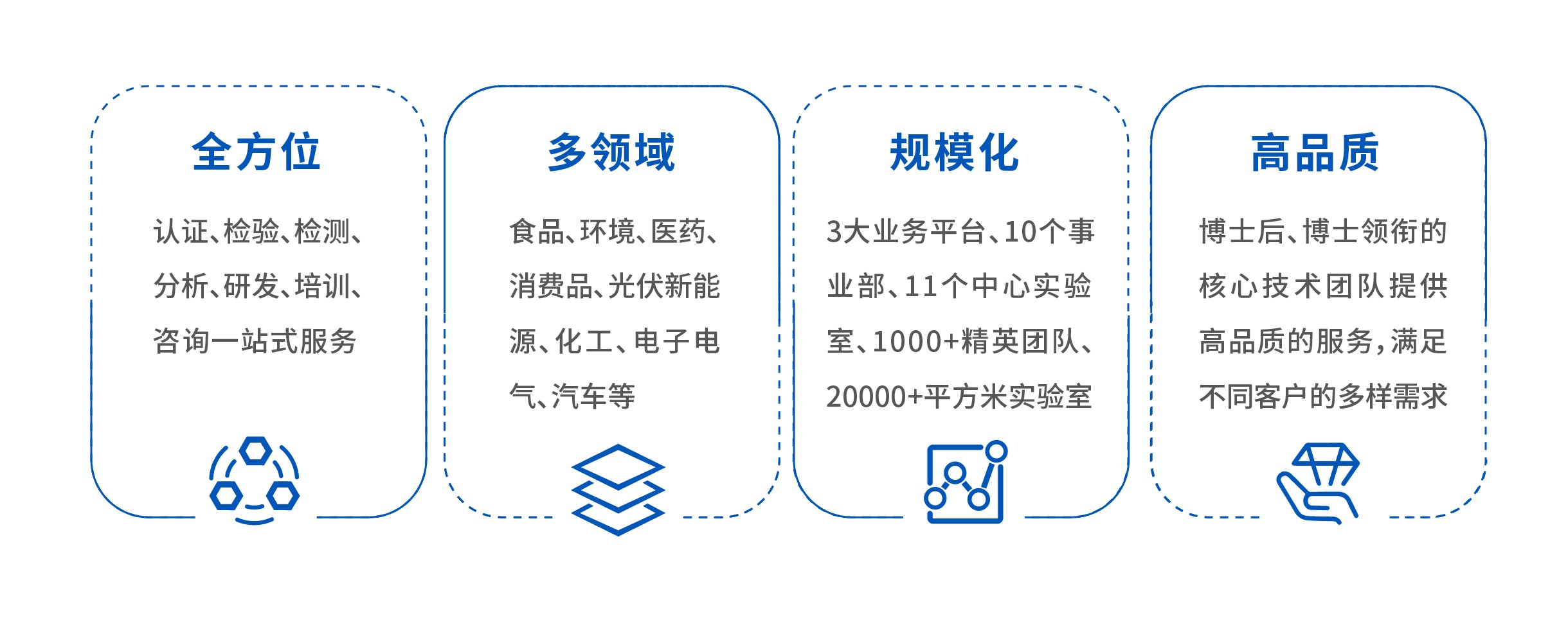
全方位的服务内容,多领域的服务能力,规模化的服务平台、高品质的服务质量
上一篇:
一次性使用输注器具产品 下一篇:
药包材相容性测试 






