一次性使用输注器具产品包装要求
产品包装验证可依据有关国内、国际标准进行(如GB/T19633、ISO11607、ASTM D-4169等),进行产品的包装验证。包装材料的选择应至少考虑以下因素:包装材料的物理化学性能;包装材料的毒理学特性;包装材料与产品的适应性;包装材料与成型和密封过程的适应性;包装材料与灭菌过程的适应性;包装材料所能提供的物理、化学和微生物屏障保护;包装材料与使用者使用时的要求(如无菌开启)的适应性;包装材料与标签系统的适应性;包装材料与贮存运输过程的适合性。
一次性使用输注器具产品灭菌要求
需进行产品灭菌方法的选择依据及验证。器械的灭菌应通过GB 18278、GB18279或GB18280确认并进行常规控制,无菌保证水平应保证(SAL)达到1×10-6。灭菌过程的选择应考虑以下因素:产品与灭菌过程间的适应性;包装材料与灭菌过程的适应性。
一次性使用输注器具产品稳定性要求(有效期验证)
包括产品有效期和产品包装有效期。产品稳定性验证可采用加速老化或实时老化的研究,实时老化的研究是唯一能够反映产品在规定储存条件下实际稳定性要求的方法。加速老化研究试验的具体要求可参考ASTM F1980。在进行加速老化试验研究时应注意:产品在选择的环境条件的老化机制应与在实时正常使用环境老化条件下真实发生产品老化的机制一致。对首次注册未提交实时老化研究资料的,企业在重新注册的资料中应提交实时老化研究资料以确定产品的实际稳定性。
一次性使用输注器具有关危害清单
该类产品进行危害判定时,至少应有但不限于以下几方面:
(1)原材料的生物学和化学危害
如材料的生物不相容,材料变更等产生的风险。同时还应特别关注如:
①可抽提物的成分与潜在的生物学危险。包括和可能输注药物的相互作用、和血液成分的相互作用、生物学评价(按GB/T16886.1规定进行)等。可抽提物不仅仅是水的抽提物,还应包括植物油、聚乙二醇400和其他提取剂的抽提物。例如:聚氯乙烯(PVC)常用的增塑剂DEHP与脂溶性溶液接触后容易浸出,应对使用DEHP进行风险评估等。
②用于药物输注的器材还应排除由于器具对药物的吸附而导致药物浓度不足对治疗的影响。
(2)生产加工过程可能产生的危害
包括生物学、化学、使用功能、信息等方面的危害。如:微粒污染、热原反应、断针、漏液、功能失效、标识不清等。同时还应特别关注如:
①热原反应。热原反应是一次性医用器具(耗材)最严重的不良反应之一。应注意两点:a)热原是用灭菌的方法无法消除的;b)除内毒素外化学致热物质亦可引起热原反应。因此,不能以单纯检测内毒素的存在与否来判定有无热原反应的潜在风险,必须从生产工艺及过程控制来保证防止热原物质侵入产品。同时要采用批批检验的方法来及时发现可能出现的热原物质。
②洁净生产环境。
③工艺用水。
④添加剂。
(3)产品包装可能产生的危害
如包装破损、标识不清等。
(4)灭菌过程可能产生危害
如灭菌方式对产品不适宜、产品未完全灭菌、灭菌过程产生的有害物质(如环氧乙烷)等。
(5)产品的不正确使用所产生的可能的危害
如无针接头每次使用前未正确消毒,防针刺产品未正确启动其防针刺装置等。
英格尔,聚力价值信任
- 标准规范
|
- 合作伙伴
|
- 仪器设备
|
- 集团优势
恪守全球标准规范
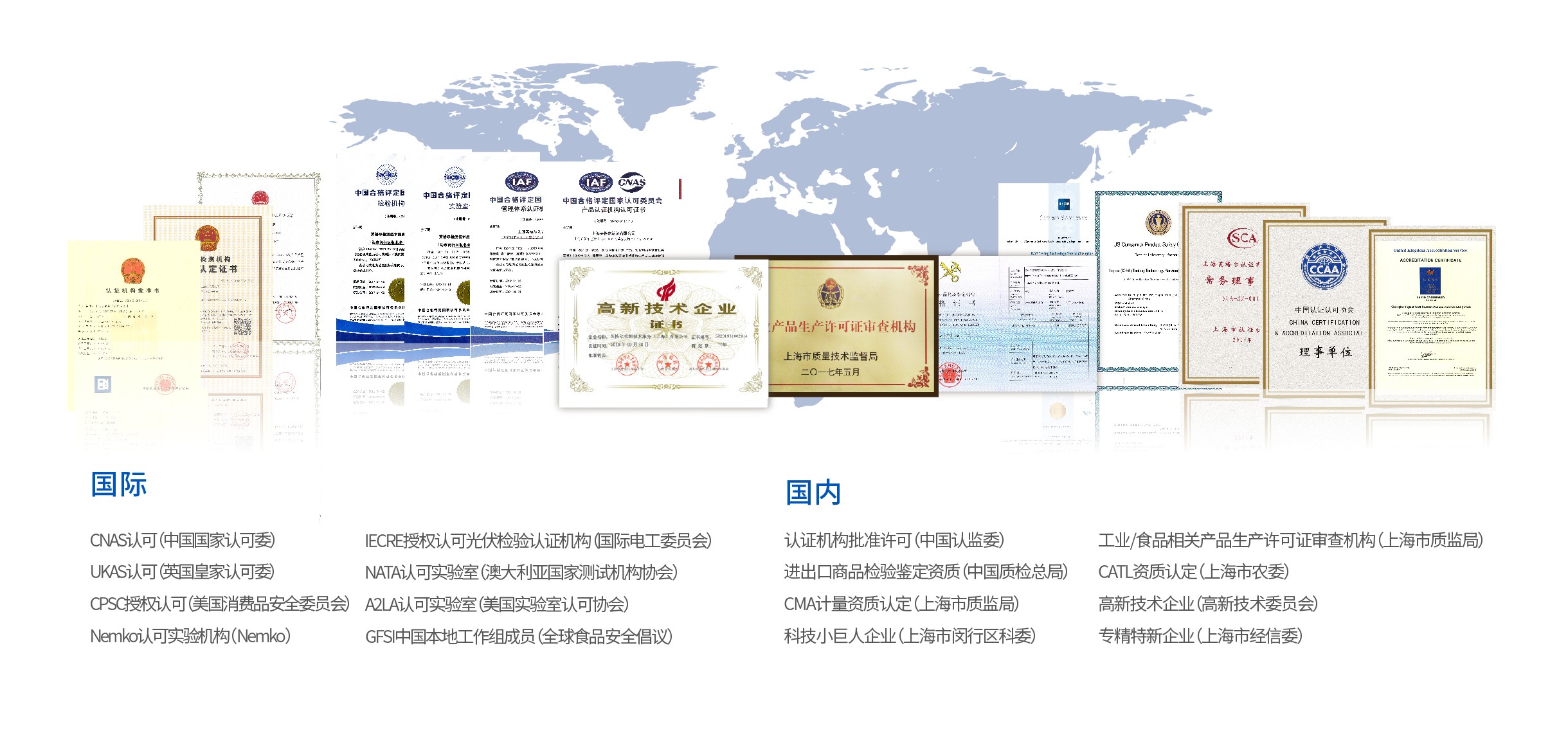
大型企业、政府机构、高效研发机构

一线品牌(沃特世、赛默飞、安捷伦、戴安等)高配实验室设备

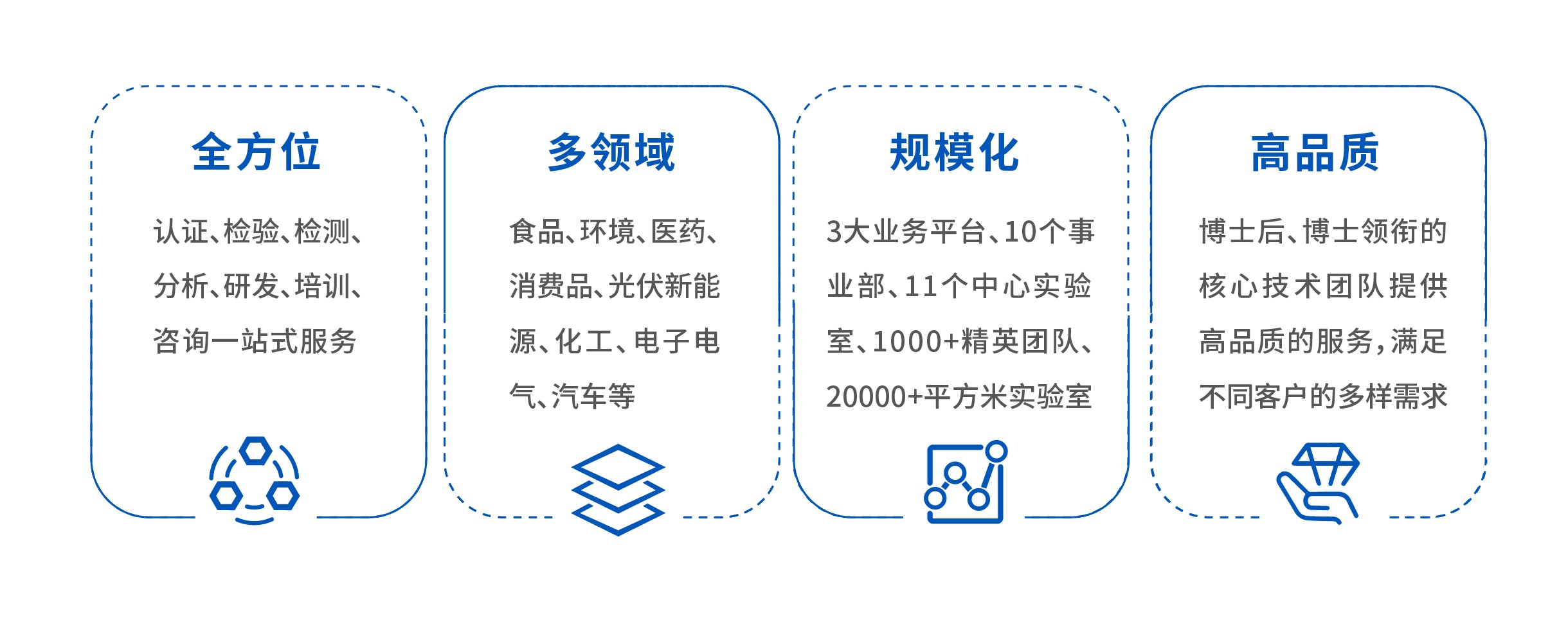
全方位的服务内容,多领域的服务能力,规模化的服务平台、高品质的服务质量
上一篇:
一次性使用输注器具研发实验要求 下一篇:
医疗器械药物相容性试验 






