化学注射剂一致性评价涉及的包装相容性指导原则主要有《化学注射剂与塑料包装材料相容性技术指导原则(试行)》、《化学注射剂与药用玻璃包装容器相容性技术指导原则(试行)》和《化学注射剂与弹性体密封件相容性技术指导原则(试行)》。在上述指导原则的基础上,本文从药物申请者的角度对每一条指导原则进行了分析,以期给药物研究者一些方向和实际的指导。
与药物直接接触的注射用包装材料和容器通常包括塑料(聚乙烯、聚丙烯、环状聚烯烃等。)、玻璃(钠钙玻璃、低硼硅玻璃、中硼硅玻璃、高硼硅玻璃)、弹性体(橡胶、热塑性弹性体)等。药物评价中心关于化学注射液与塑料、玻璃、弹性体配伍性的指导原则包括:化学注射液与塑料包装材料配伍性的技术指导原则(试行)[1]化学注射液与药用玻璃包装容器配伍性的技术指导原则(试行)[2]化学注射液与弹性体密封件配伍性的技术指导原则(试行)[3]等等。2020年5月,行业翘首以盼的化学注射剂仿制药质量和疗效一致性评价技术要求出台[4]。经过2017年和2019年的两次草案,美国食品药品监督管理局正式发布了该草案。自此,注射用仿制药质量和疗效一致性评价有了正式的法律依据,涉及注射剂生产、质量、研发等技术要求。以注射剂与直接接触药物的包装材料和容器的相容性研究为例。建议药品申请人按照上述指导原则研究直接接触药品的包装材料和容器的相容性。注射用内包装材料的质量和性能应不低于对照制剂,使药品质量与对照制剂一致。
一、药包材相关法律法规的要求
注射用药用包装材料的标准以国家医药产品管理局颁布的YBB标准和注册标准为准。包装材料批准上市前,应根据相关技术指导原则进行相容性和安全性研究。因此,批准上市的药包材可以在安全性、适应性、稳定性、功能性、保护性和方便性方面提供基本保证。但由于各种注射剂的工艺、处方、pH值、离子强度不同,在涉及具体的注射剂品种时,药品申请人由于包装材料的相容性试验往往与加速试验和长期稳定性试验同时进行,需要较长的时间。一旦出现迁移试验不合格等问题,需要花费大量的人力物力重新更换包装材料进行相容性试验,严重影响R&D循环。因此,前期选择包装材料的种类和生产厂家就显得尤为重要。对于仿制药,选择与原生产厂家同类型的包装材料,可能会大大降低更换包装材料的可能性。另外,多了解拟选用厂家的包装材料的制备工艺和添加剂种类,并结合自研品种的实际情况,进行风险评估,进而选择具体厂家的包装材料进行包装材料相容性试验,是药品R&D人员需要考虑的工作。欧洲药典第9.0版附录3.1“用于制造包装材料的材料”提供了用于制造注射包装材料的聚乙烯(PE)和聚丙烯(PP)中可用的添加剂种类以及每种添加剂的可接受限度。在列出的添加剂中,每种塑料添加的抗氧化剂不得超过三种,总量不得高于0.3%。如果包装材料成分中使用的塑料物质的添加剂属于表中所列的常用添加剂,且在包装材料中的含量符合要求,则认为包装材料中所含添加剂的量符合要求。因此,建议药品申请人选择添加剂成分和限量符合该要求的包装材料生产企业。2018年,国家美国食品药品监督管理局发布了《化学品与弹性密封件相容性研究技术指导原则(试行)》。本指导原则在附录中列出了弹性密封件慎用的添加剂品种,目的是提醒弹性密封件制造商和药品制造商对此给予足够的重视。弹性体密封件制造商应尽量避免在密封件的生产过程中谨慎使用添加剂,并在密封件生产的源头控制风险。
二、包装材料相容性试验的总体研发思路
塑料、玻璃和弹性体通常用作与药物直接接触的注射剂的包装材料。塑料是一种以高分子量合成树脂(聚乙烯、聚丙烯、环状聚烯烃等)为原料的塑料材料。)为主要成分,并添加适量的添加剂,如润滑剂、稳定剂、着色剂、阻燃剂、增塑剂等。或者是固化和交联的刚性材料。常用的塑料包装形式有:输液瓶、多层共挤袋、塑料安瓿等。2012年,国家美国食品药品监督管理局公布了《化学注射剂与塑料包装材料相容性研究技术指南(试行)》,为包装材料相容性试验提供了明确的研发思路:
(1)首先,确定直接接触药品的包装材料成分。通常,塑料内包装材料会配有橡胶塞作为密封;
(2)了解和分析包装成分的具体成分(尤其是添加剂的成分),包装成分与药品的主要接触方式、接触面积、接触条件,以及药品的生产工艺,重点是灭菌方法(温度、时间等。);
(3)对用于包装各种成分的不同包装材料进行了萃取实验,并对可萃取物进行了初步风险评估,预测了相互作用研究中可能出现的萃取物;
(4)接下来可以进行制剂与包装系统的相互作用试验,包括两项试验:迁移试验和吸附试验,以获得包装系统对原辅料的吸附能力和药物中提取物的相关信息;
(5)评估药品中检测出的提取物水平的安全风险;
(6)分析总结注射剂及其包装材料的相容性试验结果,最终得出拟采用的内包装材料是否适用于目标药物的结论。
三。预灌封注射器组件的兼容性测试
本文以小容量注射常用的预灌封注射器(玻璃注射器)为例,根据国家总局颁布的现有指导原则,探讨如何开展化学药品与预灌封注射液的化学配伍性实验研究。
由于预灌封注射器价格较高,通常采用无菌过滤灭菌的疫苗、生物制品或生化药品等附加值较高的药品,不涉及包装材料与药品一起高温灭菌。与药液直接接触的预灌封注射器组件包括玻璃针管、不锈钢注射针、氯/溴丁基橡胶塞、橡胶塞和针管表面具有润滑作用的硅油(聚二甲基硅氧烷)。因此,基于以上信息,模拟萃取试验涉及玻璃针、丁基橡胶塞、不锈钢注射针头和硅油的模拟萃取试验。由于每种成分的成分不同,使用的提取溶剂也不同,所以需要分别进行提取试验。
英格尔,聚力价值信任
- 标准规范
|
- 合作伙伴
|
- 仪器设备
|
- 集团优势
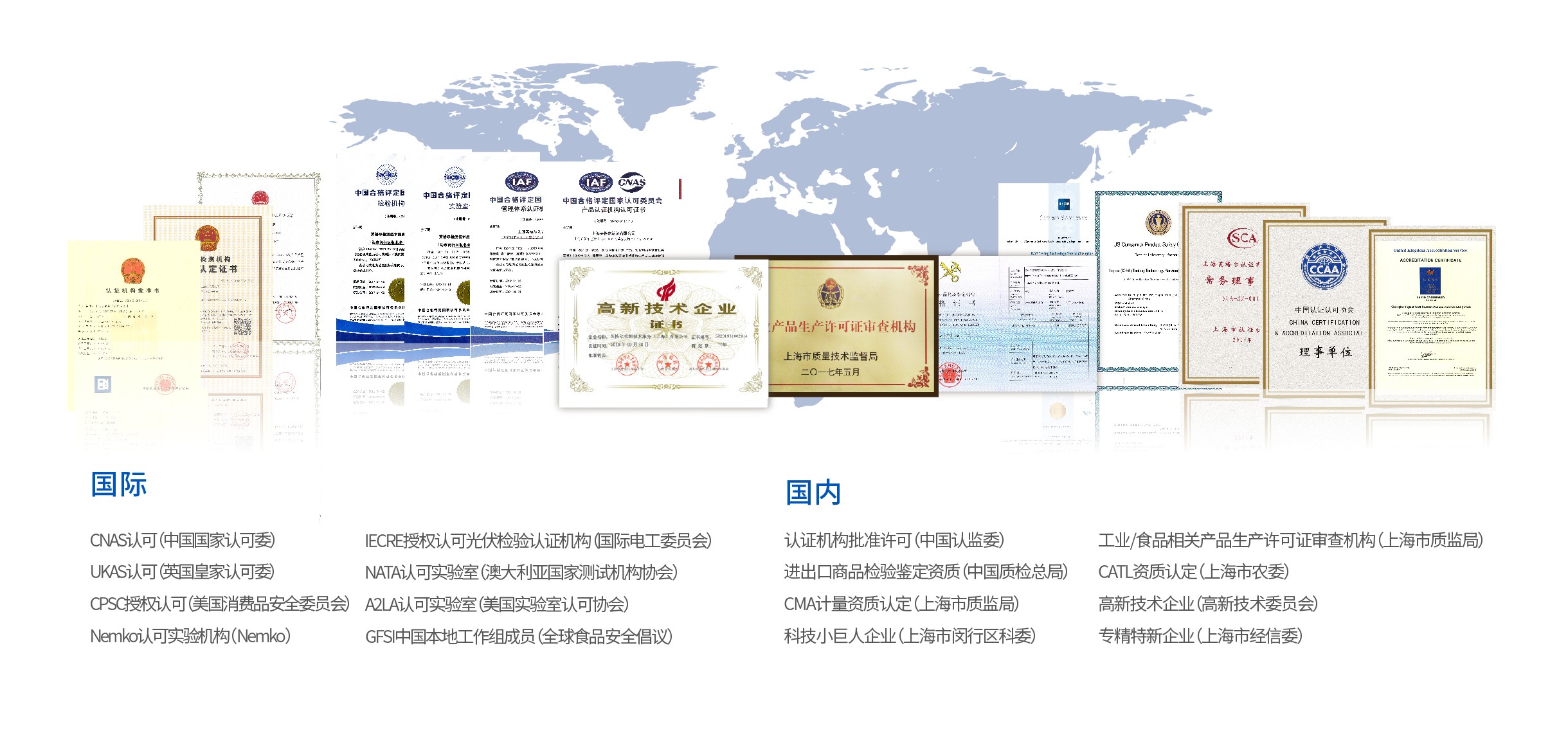
恪守全球标准规范
大型企业、政府机构、高效研发机构

一线品牌(沃特世、赛默飞、安捷伦、戴安等)高配实验室设备

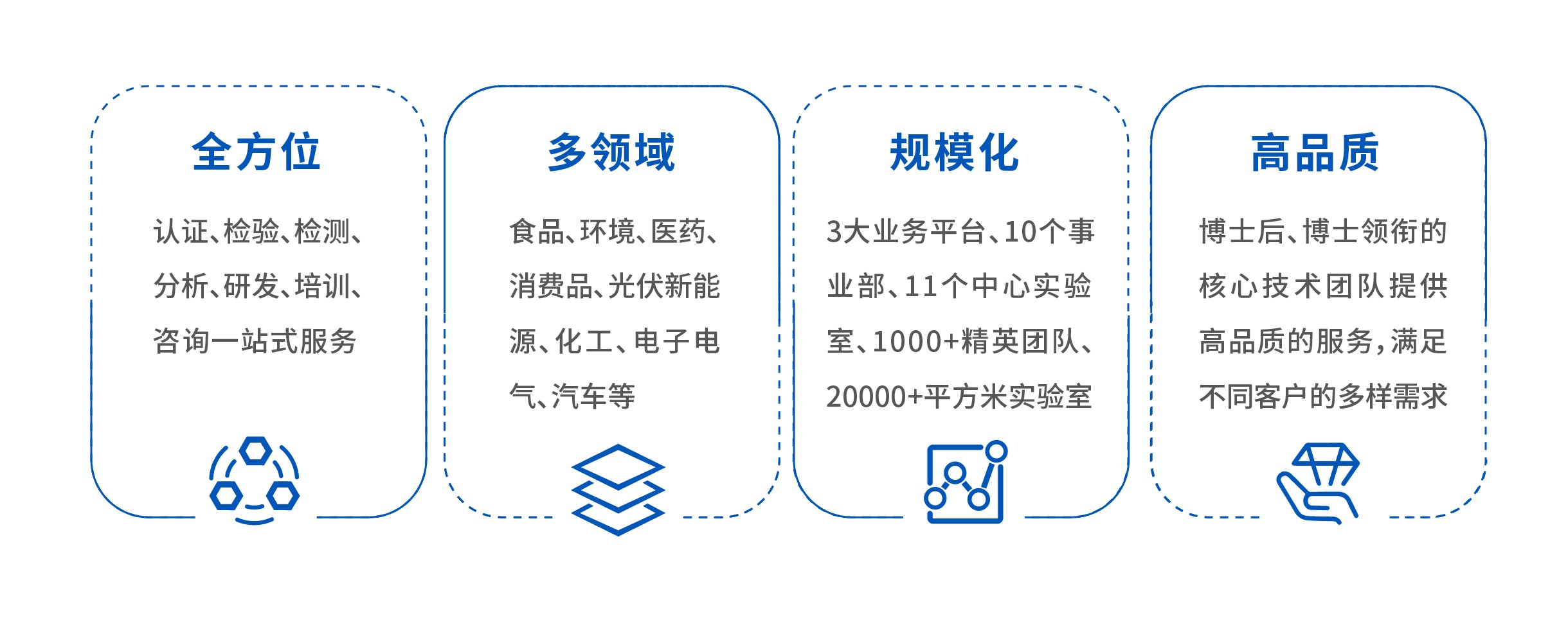
全方位的服务内容,多领域的服务能力,规模化的服务平台、高品质的服务质量
上一篇:
相容性检测中心 下一篇:没有了







