3月30日,国家美国食品药品监督管理局网站发布关于调整《医疗器械目录》(2022年第30号)部分内容的公告。全文如下。
国家美国食品药品监督管理局关于调整《医疗器械分类目录》部分内容的公告(2022年第30号)
为进一步深化医疗器械审评审批制度改革,根据医疗器械行业发展和监管工作实际,按照《医疗器械监督管理条例》和《医疗器械分类目录动态调整工作程序》的有关要求,国家美国食品药品监督管理局决定对医疗器械分类目录的部分内容进行调整。现将有关事项公告如下:
一、调整内容
调整《医疗器械目录》涉及的27类医疗器械内容。具体调整内容见附件。
二、实施要求
(一)附件中调整涉及的09-07-02射频治疗(非消融)设备产品,自本公告发布之日起,射频治疗仪和射频皮肤治疗仪可根据《医疗器械注册备案管理办法》(国家市场监督管理总局令第47号)申请注册。自2024年4月1日起,未依法取得《医疗器械注册证》的,不得生产、进口和销售射频治疗仪和射频皮肤治疗仪。
射频治疗仪和射频皮肤治疗仪的相关注册人和生产企业要切实履行产品质量安全主体责任,全面加强产品全生命周期质量管理,确保上市产品的安全性和有效性。自本公告发布之日起,射频治疗器械和射频皮肤治疗器械相关注册人和生产企业应主动向进口产品所在地(代理商所在地)省级药品监督管理部门报告产品按照医疗器械发展注册计划、适用的安全标准承诺、生产质量管理体系及其运行情况、客户投诉处理情况和不良事件的制度及执行情况等。省级药品监督管理部门应当建立企业信用档案,加强对此类产品注册人和生产企业的检查,督促企业落实主体责任,加快完成产品注册,完善质量管理体系。自2024年4月1日起,未取得医疗器械生产经营许可证(备案)的企业不得从事相关产品的生产和销售。
(二)其他内容有调整的产品,自本公告发布之日起,药品监督管理部门将按照《医疗器械注册备案管理办法》、《关于公布医疗器械注册申报资料要求和批准文件格式的公告》等规定,按照调整后的类别受理医疗器械注册申请。
对于已经受理但尚未完成注册审批(包括首次注册和续展注册)的医疗器械,药品监督管理部门将继续按照原受理类别进行审评审批。准予注册的,颁发医疗器械注册证,并在注册证备注栏注明调整后的产品管理类别。
对于已注册的医疗器械,管理类别由第三类调整为第二类的,医疗器械注册证在有效期内继续有效。需要续展的,注册人应当在医疗器械注册证有效期满前六个月,根据变更后的类别向相应的药品监督管理部门申请续展注册。准予延续注册的,按照调整后的产品管理类别发放医疗器械注册证。
医疗器械注册在注册证有效期内发生变更的,注册人应当向原注册部门申请变更注册。按照医疗器械原分类目录发放原注册证书的,应当在本公告涉及产品变更的注册文件备注栏中注明实施公告后的产品管理类别。
(三)各级药品监督管理部门要加强对医疗器械目录内容调整的宣传和培训,切实做好相关产品的审评审批和上市后监管工作。
英格尔,聚力价值信任
- 标准规范
|
- 合作伙伴
|
- 仪器设备
|
- 集团优势
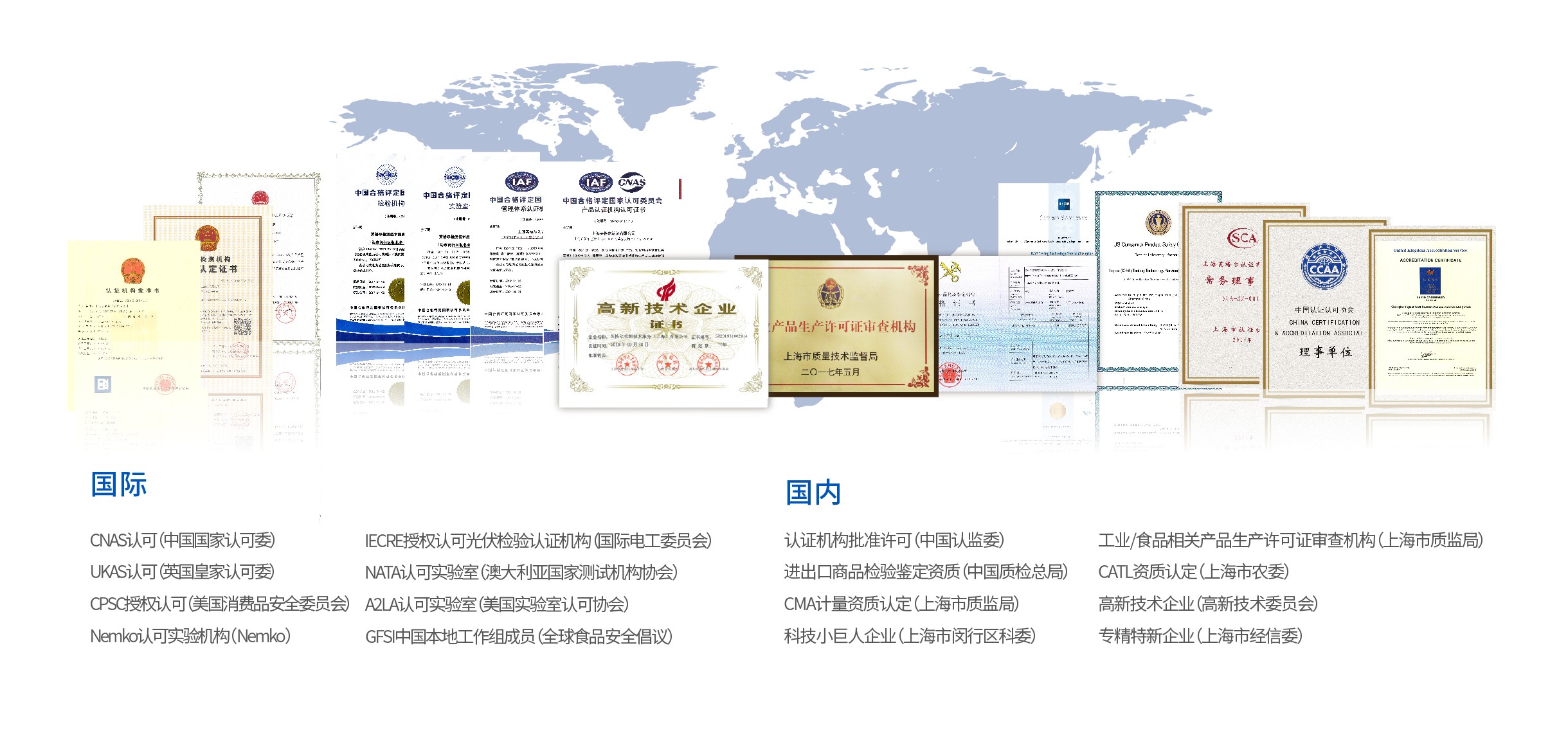
恪守全球标准规范
大型企业、政府机构、高效研发机构

一线品牌(沃特世、赛默飞、安捷伦、戴安等)高配实验室设备

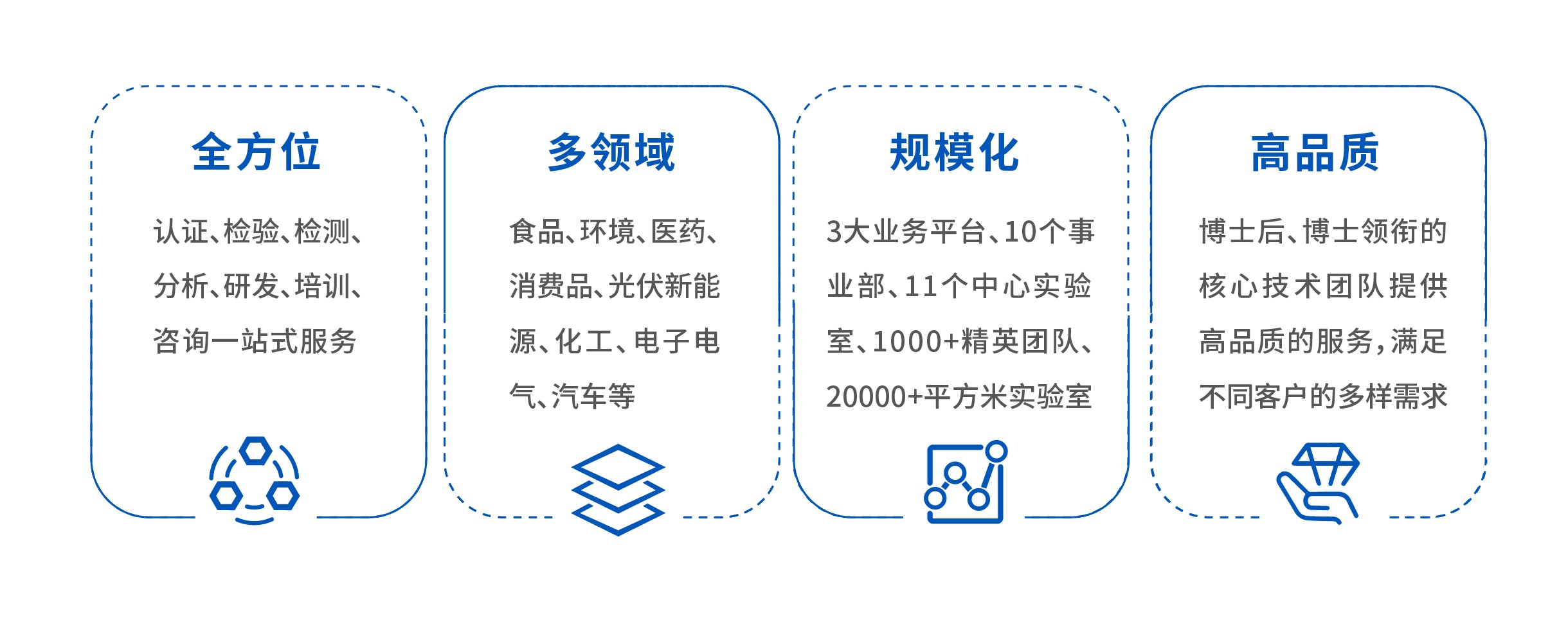
全方位的服务内容,多领域的服务能力,规模化的服务平台、高品质的服务质量
上一篇:
如何确定医疗器械名称 下一篇:
微生物制药流程控制 






