近年来,随着全球创新药研发热情高涨,制药企业的综合实力不断提升,越来越多疾病正在被攻克。仅2020年,就有53款新药冲破疫情阻碍获得美国食品药品监督管理局(FDA)批准上市。然而,专利到期、研发成本增加以及新药研发成功率不断下降等因素同时也给制药行业带来了巨大的挑战
从靶点发现、成药性的研究、工艺的开发到制剂生产,新药研发的每一个环节都十分关键。不过,就大分子药物的研发而言,上游细胞培养工艺开发环节十分关键。由于抗体类药物涉及到蛋白质翻译后的修饰,必须在细胞株筛选和后期细胞培养工艺开发阶段提前考虑,才能够满足监管部门对质量、安全性和有效性的要求。
从工艺供应商的角度而言,影响药物问世的首先是企业最初对细胞系的选择。多数创新生物药是由动物细胞培养而来,因此这些药物后期进展是否高效,实际上很大程度上受细胞“出身”的影响。
“先天决定后天,不同的细胞往往决定了后期企业可能会遇到的挑战。当然,在确定了细胞系之后,各种工艺的开发和优化也会影响产品后期的临床走向。”
无论是大分子药物还是小分子药物,最终研发目的都是帮助人们抵御疾病、恢复健康。“药品最终将应用于人体。如何保证它们从研发、临床再到大规模生产阶段均具备稳定一致的安全性和有效性,这是生物制药企业必须思考和解决的问题。另外,从此次的新冠疫情来看,制药企业以及工艺供应商如何保证全球供应链的稳定和连续性,或许也值得思索。”
2017年,中国正式加入ICH(“人用药品注册技术要求国际协调会议”),在药品研发和注册国际化道路上迈出了历史性一步。随着中国本土新药“出海”渐成趋势,越来越多临床项目开启了中美双报、中欧双报甚至三地申报的战略。
临床项目在不同国家申报无疑给制药企业提出了更高的要求。以中美双报为例,美国FDA监管水平可谓处于世界前列,在21世纪初就引入了QbD(质量源于设计)理念,指导药物研发,因此临床申报的标准往往更高。这就要求国内制药企业,从最初靶点的筛选开始就应考虑质量问题。
“企业研发某一个产品,只有明确了要实现的目标,才能指导接下来需要设计的工艺。工艺为产品服务,而产品则为临床服务。”
我国生物制药产业正迈入蓬勃发展阶段,生物制药创新活力迸发,与此同时,行业间的竞争日趋激烈,生物制药企业对于制药链条上研发和产业化所需的工艺及设备需求也在不断扩大。在创新药问世的道路上,绝不仅仅是药企一方在孤军奋战,
英格尔工艺解决方案提供商也是助力新药问世的重要支撑。二者共同携手,才能更好地推进新药问世进程。
英格尔,聚力价值信任
- 标准规范
|
- 合作伙伴
|
- 仪器设备
|
- 集团优势
恪守全球标准规范
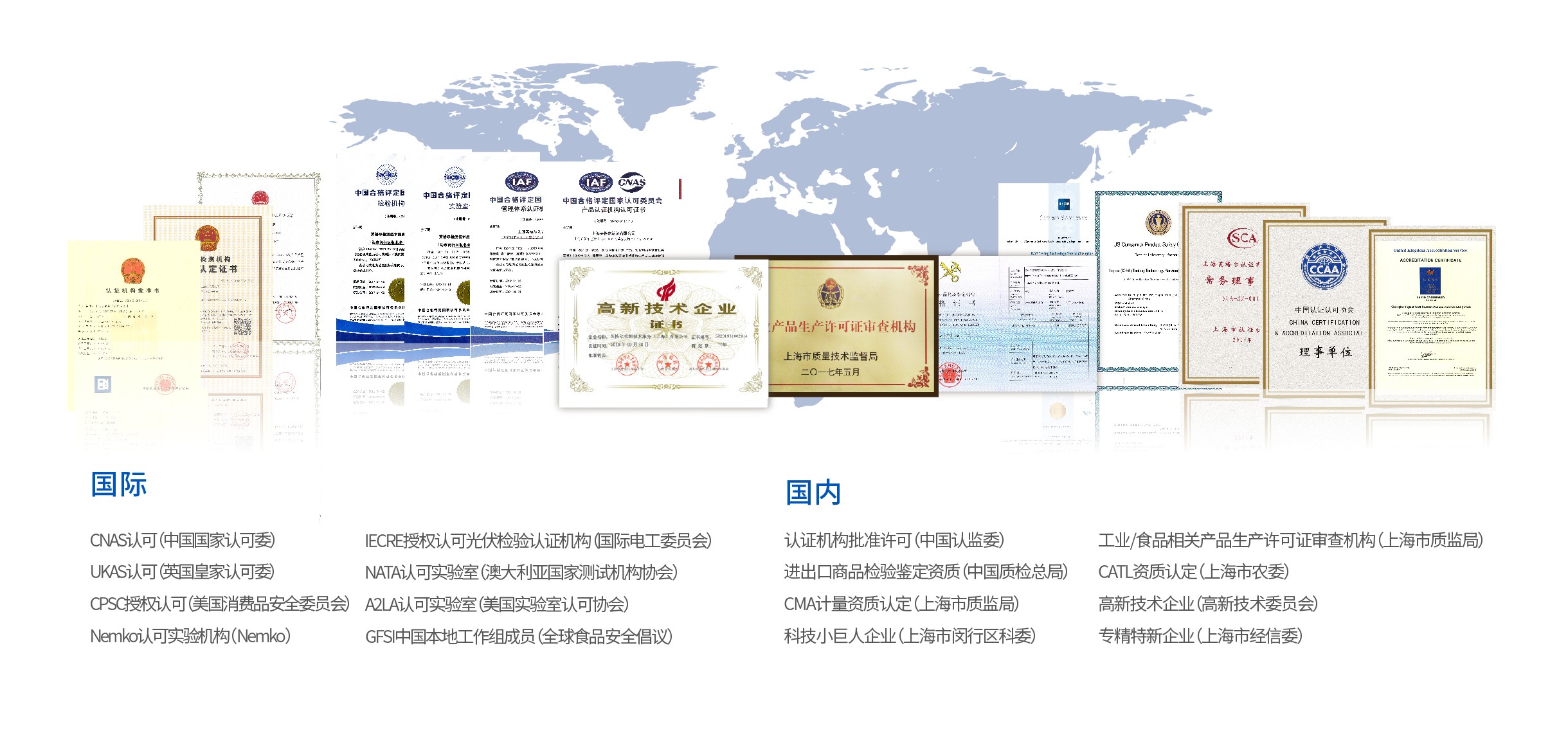
大型企业、政府机构、高效研发机构

一线品牌(沃特世、赛默飞、安捷伦、戴安等)高配实验室设备

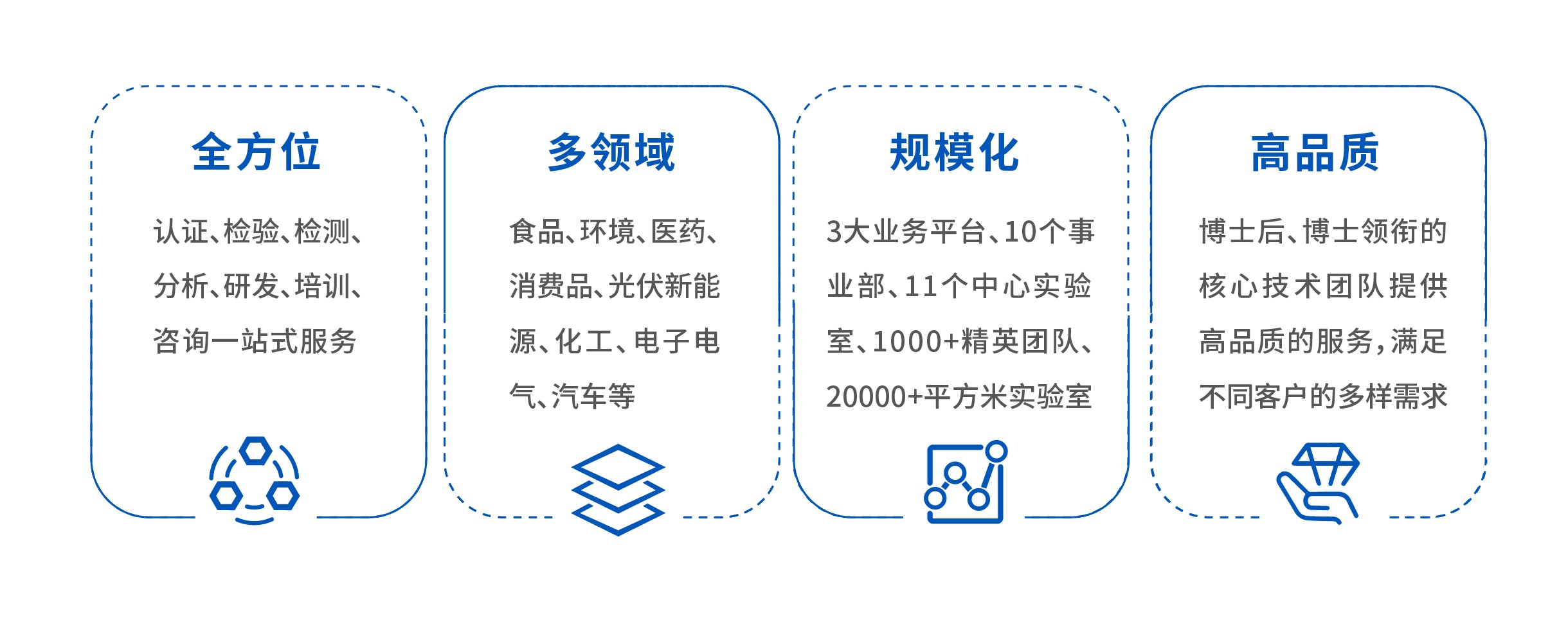
全方位的服务内容,多领域的服务能力,规模化的服务平台、高品质的服务质量
上一篇:
创新药研发中的技术壁垒 下一篇:
创新药物研发CMC阶段性研究 






