新药从研发到上市需要经过哪些流程?
一、临床前研究
1.研发(一般2-3年)
实验室研究寻找具有治疗特定疾病潜力的新化合物
1
发现和确认药物靶点
这是所有工作的起点。只有确定目标,才能为后续工作提供依据。
2
筛选合成化合物
根据靶点的空间结构,从虚拟化合物库中筛选出一系列可匹配的分子结构,称为先导化合物。
3
验证和优化活性化合物
并非所有先导化合物都能满足要求。现阶段需要通过体外细胞试验验证,初步筛选出活性高、毒性低的化合物,并根据结构关系进行结构优化。
还有一种化合物对目标A靶点没有影响,但可能对其他B靶点没有影响,C目标有很好的活性,暂时不表。
2.临床前实验(一般2-4年)
本阶段的目的是评估药物的药理和毒理作用、吸收、分布、代谢和排泄(ADME)。二是研究生产工艺、质量控制、稳定性等(CMC)。
第一部分实验需要在动物层面进行,细胞实验的结果有时与活动动物有很大的不同。这一步的目的是确定药物的有效性和安全性。
第二部分需要符合GMP完成所需车间。
1
药理学研究
包括:药效学、药动学
2
毒理学研究
急毒、长毒、生殖毒性、致癌、致畸、突变
3
制剂的开发
制剂开发是药物应用的重要组成部分。例如,有些药物口服吸收不良,需要开发成注射剂。有些药物会失去胃酸中的活性,需要开发成肠溶性制剂。有些化合物溶解性差,可以通过制剂部分解决。有些需要局部给药,需要通过制剂开发成雾化剂、膏剂等。
二、临床试验审批Investigational New Drug(IND)
三、临床试验(一般3-7年)
人体试验分为三个阶段:
?Ⅰ正常人临床20-100例,主要进行安全评价。
?Ⅱ100-300例临床病例,主要用于有效性评估。
?Ⅲ300-5000例临床患者,扩大样本量,进一步评价。
四、新药上市审批New DrugApplication
●NDA申报资料—CTD(CommonTechnical Document)
CTD主要由五个模块组成:
①行政法规信息
②概述:药物质量、非临床试验和临床试验的高度总结
③详细介绍药品质量
④非临床研究报告
⑤临床研究报告
英格尔,聚力价值信任
- 标准规范
|
- 合作伙伴
|
- 仪器设备
|
- 集团优势
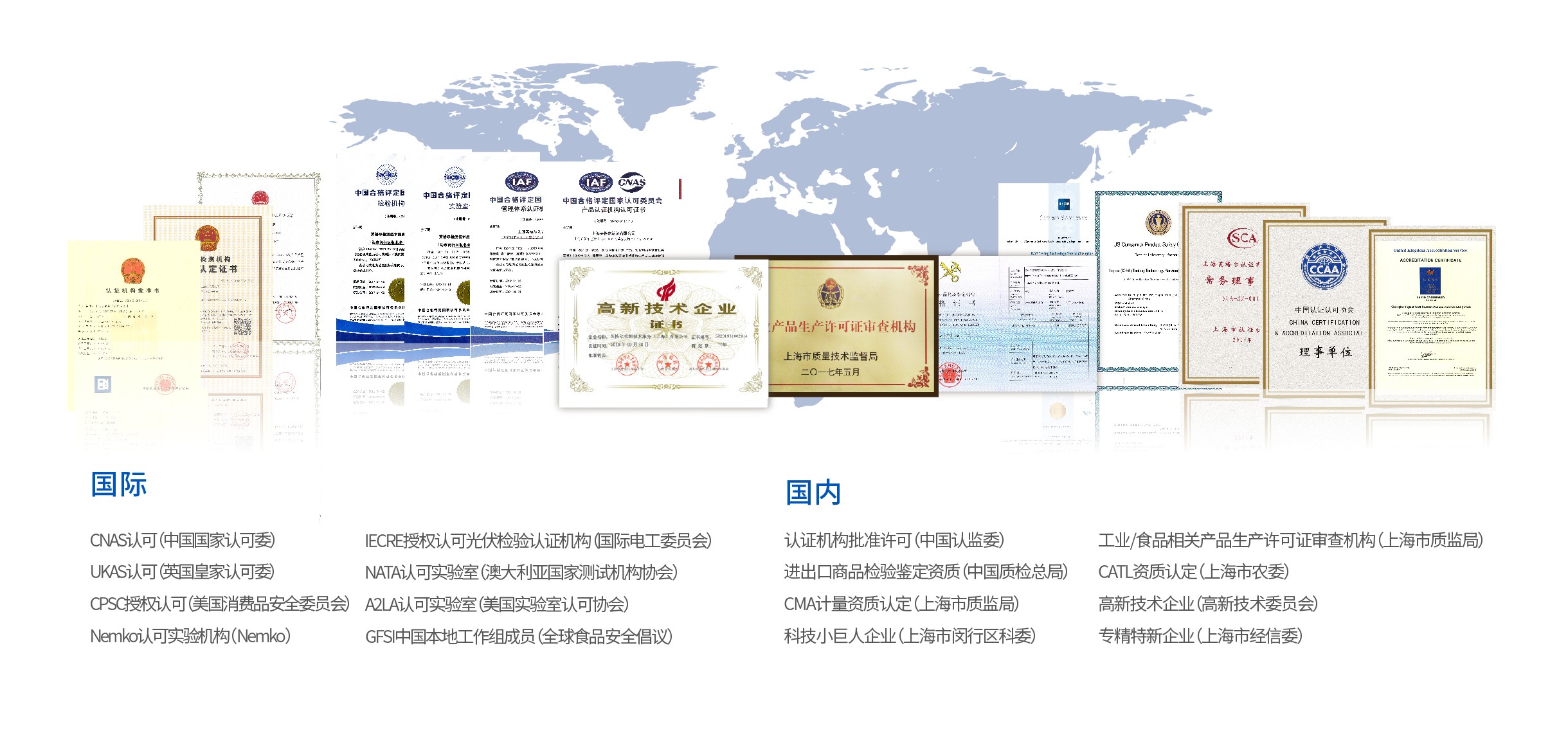
恪守全球标准规范
大型企业、政府机构、高效研发机构

一线品牌(沃特世、赛默飞、安捷伦、戴安等)高配实验室设备

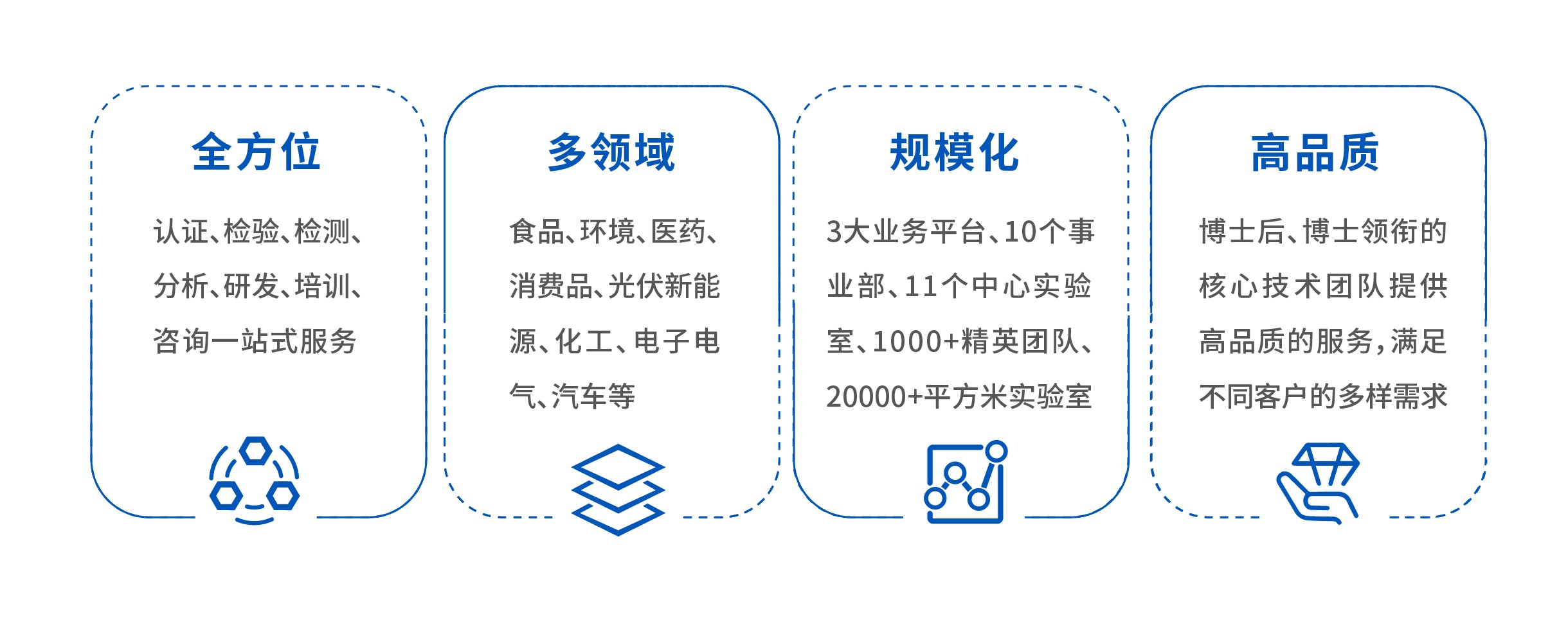
全方位的服务内容,多领域的服务能力,规模化的服务平台、高品质的服务质量
上一篇:没有了 下一篇:
医药研发 






