检查药物中存在的微量杂质,首要的问题就是要选择一个专属性强的方法,使药物对业含微量杂质的检测也不产生干扰。所以药物中杂质的检查主要是依据药物与杂质在物理楼或化学性质上的差异来进行。
药物与杂质在物理性质上的差异,主要指药物与杂质在外观始分配或吸附以及对光的吸收等性质的差别;在化学性质上的差异,主要指药物与杂质对某学反应的差别,一般地,是杂质与试剂反应,而药物不反应。根据杂质的控制要求,可以进行量检查,也可以对杂质进行定量测定。
杂质的研究规范
制药企业应该按照经国家药品监督管理部门依法审查批准的规定工艺和规定原辅料进行药品的生产,如果变更生产工艺或原辅料,并由此而带进新的杂质,需对原质量标准进行修订,并应依法向有关药品监督管理部门申报批准。在新药的研发中,应该对新药中的杂质进行检测和安全性研究。
杂质控制要合理,即合理地确定杂质检查项目与限度,合理地选择杂质检查方法。有机杂质在药品质量标准中的项目名称:
1、以杂质的化学名称作为项目名称
当被检查的杂质是已知化合物时(特定杂质),就以该化合物的化学名称作为质量标准中的项目名称。例如:卡比马唑及其片剂中的“甲巯咪唑',阿司匹林中的“游离水杨酸”、磷酸可待因中的“吗啡”等。如果杂质的化学名太长,又无通用的简称,可选用相宜的简称或习称作为项目名称,并在质量标准起草说明中应写明该已知杂质的结构式。例如:肾上腺素中的“酮体”。
2、以某类杂质的总称作为项目名称
当杂质不能明确为单一物质而又知为某一类物质时,则以这类物质的总称作为项目名称。例如:硝酸毛果芸香碱中的“其他生物碱”、山梨醇中的“还原糖”和“总糖”、黄体酮中的“有关物质”、许多原料药物中的'残留溶剂'等。
3、以检测方法作为项目名称
当被检查杂质的结构未知,亦不属于具体的类别时,根据检查方法相应的名称作为项目名称。例如:“杂质吸光度”,“溶液透光率”、“易炭化物',“不挥发性杂质”等。
杂质检查项目的确定
杂质检查项目的确定要有针对性。药品标准中的杂质检查项目,应包括药物在质量研究和稳定性考察中检出的,并在批量生产中出现的杂质和降解产物。所以,原料药和制剂中的杂质检查项目,均应根据其起始原料、生产工艺及稳定性情况确定。
尤其是降解产物和毒性杂质,通常均作为必须的检查项目。除降解产物和毒性杂质外,在原料中已控制的杂质,在制剂中一般不再控制。单一对映体药物,其可能共存的其他对映体应作为杂质检查。消旋体药物,当已有其单一对映体药物的法定质量标准时,应在该消旋体药物的质量标准中设旋光度检查项目。
杂质限度的确定
杂质限量的确定要合理,在确保用药安全有效的前提下,应考虑到生产的可行性及批与批之间的正常波动,还要考虑药品本身的稳定性。可以根据原料药每日剂量来制订质控限度。
如果所制订的限度超过该限度值,就必须提供所订限度的合理性依据。有机杂质的限度规定应包括:每一个已知杂质、未知杂质及总杂质。在确定仿制药品的杂质限度时,应与已上市产品进行质量对比研究。
杂质限度的制订应考虑如下因素:
杂质及含一定限量杂质的药品的毒理学研究结果;
给药途径;
每日剂量;
治疗周期;
给药人群;
杂质药理学可能的研究结果;
原料药的来源;
在保证安全有效的前提下,药品生产企业对生产高质量药品所需成本和消费者对药品价格的承受力等。
对于创新药物,杂质限度确定的依据主要是已进行的临床前安全性研究中获得的结果,通常是要求用于临床试验的样品杂质不得超过用于临床前安全性研究的样品;对于仿制药物,可以根据已有的标准制订相应的杂质限度;对于其他新药,可参照创新药物或仿制药物的要求进行。
杂质检查方法的选择与验证
药物中杂质的检测方法包括化学法、光谱法、色谱法等,因药物结构及杂质的不同采用不同的检测方法。有机杂质的检测方法多采用色谱法,特别是HPLC法。
用于杂质检查的分析方法要求专属、灵敏。为验证杂质分析方法的专属性,可根据原料药或制剂的生产工艺及储存条件,以中间体、立体异构体、粗品、重结晶母液、经加速破坏性试验后的样品作为测试品进行系统适用性研究,考察产品中各杂质峰及主成分峰相互间的分离度是否符合要求。
当采用HPLC法检查有机杂质时,由于等度洗脱具有可能漏检杂质的缺点,所以国内外药典中也常常采用梯度洗脱,例如司帕沙星、丝裂霉素、地高辛、辛伐他丁等药物中有关物质检查都采用了梯度洗脱。
分析方法的检测限一定要符合质量标准中对杂质限度的要求,检测限不得大于该杂质的报告限度。
英格尔,聚力价值信任
- 标准规范
|
- 合作伙伴
|
- 仪器设备
|
- 集团优势
恪守全球标准规范
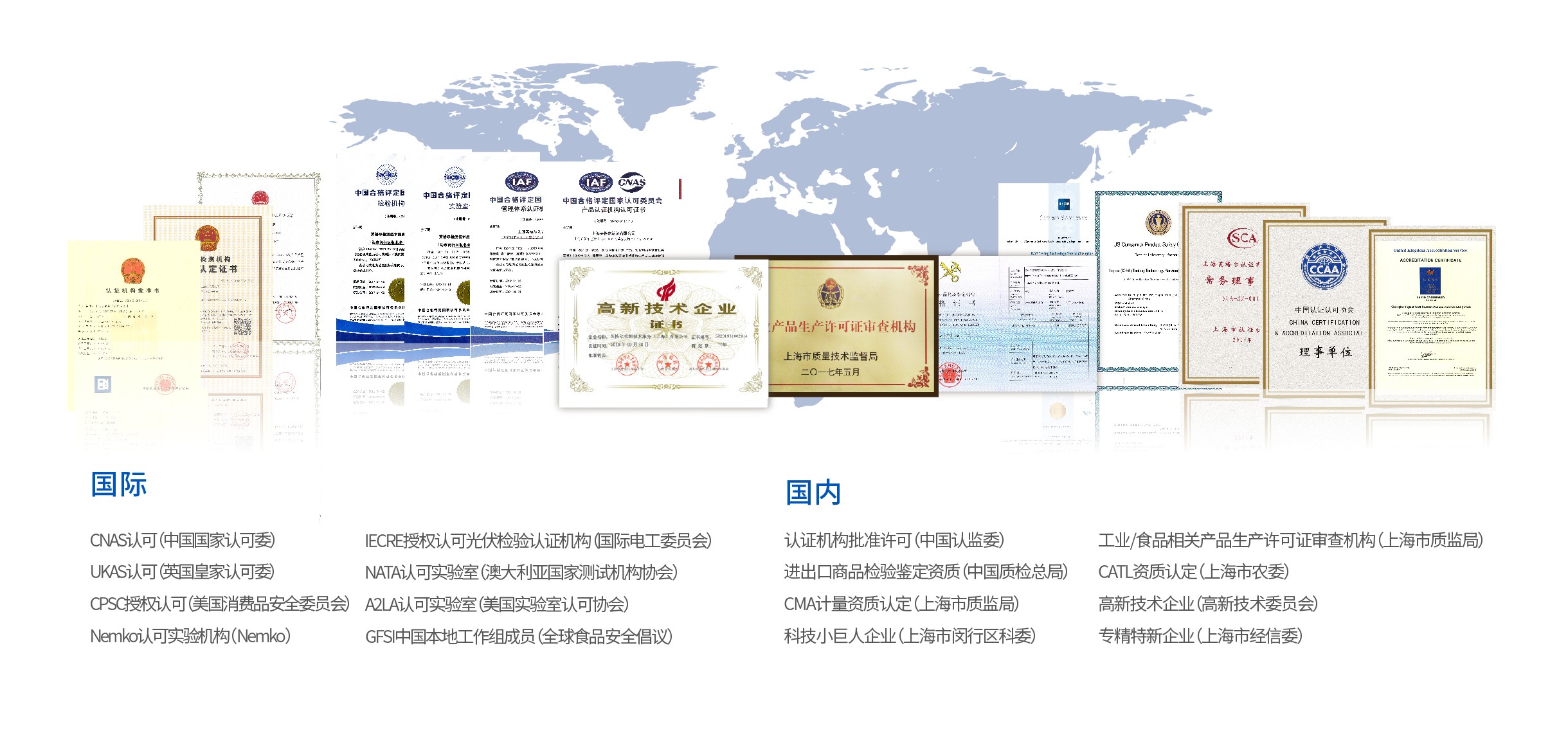
大型企业、政府机构、高效研发机构

一线品牌(沃特世、赛默飞、安捷伦、戴安等)高配实验室设备

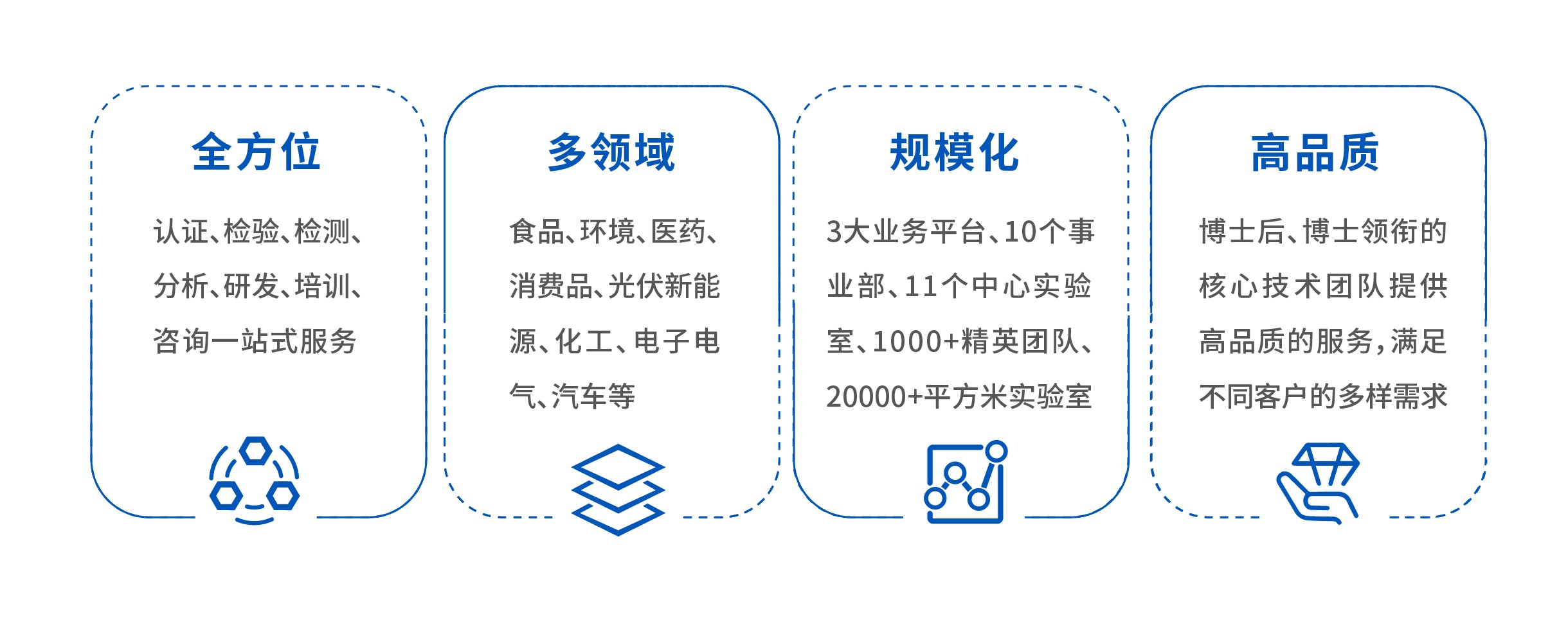
全方位的服务内容,多领域的服务能力,规模化的服务平台、高品质的服务质量
上一篇:
基因毒性杂质的独立性评估 下一篇:
遗传毒性杂质结构 






