一名药物化学工作者,工作范围不能仅仅局限于药物合成,药理、制剂、分析等工作亦不得不适当跟进,从而利于自己对锁定目标化合物的全方位了解以及对整个药物开发过程的领悟。而药物研发,作为一个系统工程,从研究、开发到生产上市,要经历许多个阶段,包括基础研究、模型的建立与开发、临床前研究、临床试验,以及注册审批与生产上市等阶段,在这些研发过程中,药物化学工作者关注更多的自然是基础研究,当确定待开发候选化合物时,分析工作自然会开始介入,为了更好的确定待开发候选化合物是否具有更好的成药性,药物稳定性研究工作就具有非常重要的指导意义(注:全文主要针对化学原料药的稳定性研究)。
药物稳定性及其研究简介
我国食药监总局对于化学药物稳定性研究所颁布的指导原则中指出,原料药(及其制剂)的稳定性是指其保持物理、化学、生物学和微生物学特性的能力,稳定性研究就是基于对原料药(及其制剂)生产工艺的系统研究和理解,通过设计试验获得原料药(及其制剂)的质量特性在各种环境因素的影响下随时间变化的规律,并据此为后续的药品处方、工艺、包装、贮藏条件和有效期/复检期的确定提供支持性信息。稳定性研究始于药品研发的初期,并贯穿于药品研发的整个过程,申请临床研究时要求临床前的稳定性结果应能保证临床试验期间试验用样品的稳定;申请生产上市时要求提交的稳定性资料应能保证产品上市后在一定期限内的稳定,并以此确定储存条件和有效期;而上市后生产企业作为产品的质量责任主体,应在产品获准上市后,对实际生产样品继续进行稳定性研究,以考察上市产品最终的稳定性,并可通过补充申请的形式修改贮存条件和有效期。
我国药品稳定性研究指导原则发展历程
国内最近的指导原则《化学药物(原料药和制剂)稳定性研究技术指导原则》,是在充分分析2005年版《化学药物稳定性研究技术指导原则》存在问题的基础上,参考2003年ICH修订的稳定性研究指导原则,以及2012年FDA发布的《仿制药稳定性研究指导原则(草案)》的基础上进行修订的。其中,2005年版《化学药物稳定性研究技术指导原则》存在“数据与商业化生产产品的实际结果差异较大、造成注册研究难以与商业化生产有效衔接等问题”;而ICH关于稳定性的指导原则共有5个,包括Q1A、Q1B、Q1C、Q1D和Q1E,其中Q1A是稳定性研究总的指导原则,“BCDE”则是不同方面的补充;《化学药物(原料药和制剂)稳定性研究技术指导原则》是在Q1A的基础上,纳入Q1B和FDA仿制药稳定性指导原则的内容,相当于化学原料药和制剂稳定性研究的总则,对简化的稳定性试验设计、结果的分析评估等在正文中有提及但未能展开阐述,后续根据需要将可能陆续起草或转化ICH Q1D和Q1E,现阶段药品研发单位及生产企业可根据需要,参考Q1D和Q1E中的相应内容。
三大稳定性试验
稳定性试验主要包括影响因素试验、加速试验和长期留样试验。影响因素试验的目的是明确药品可能的降解途径、初步为包装材料的选择提供参考信息;加速试验的目的是明确药品在偏离正常贮藏条件下的降解情况、确定长期留样试验的条件;长期稳定性试验的目的是确认影响因素试验和加速试验的结果,明确药品稳定性的变化情况,确定药品的有效期;应该说长期留样试验是稳定性试验的核心。
英格尔,聚力价值信任
- 标准规范
|
- 合作伙伴
|
- 仪器设备
|
- 集团优势
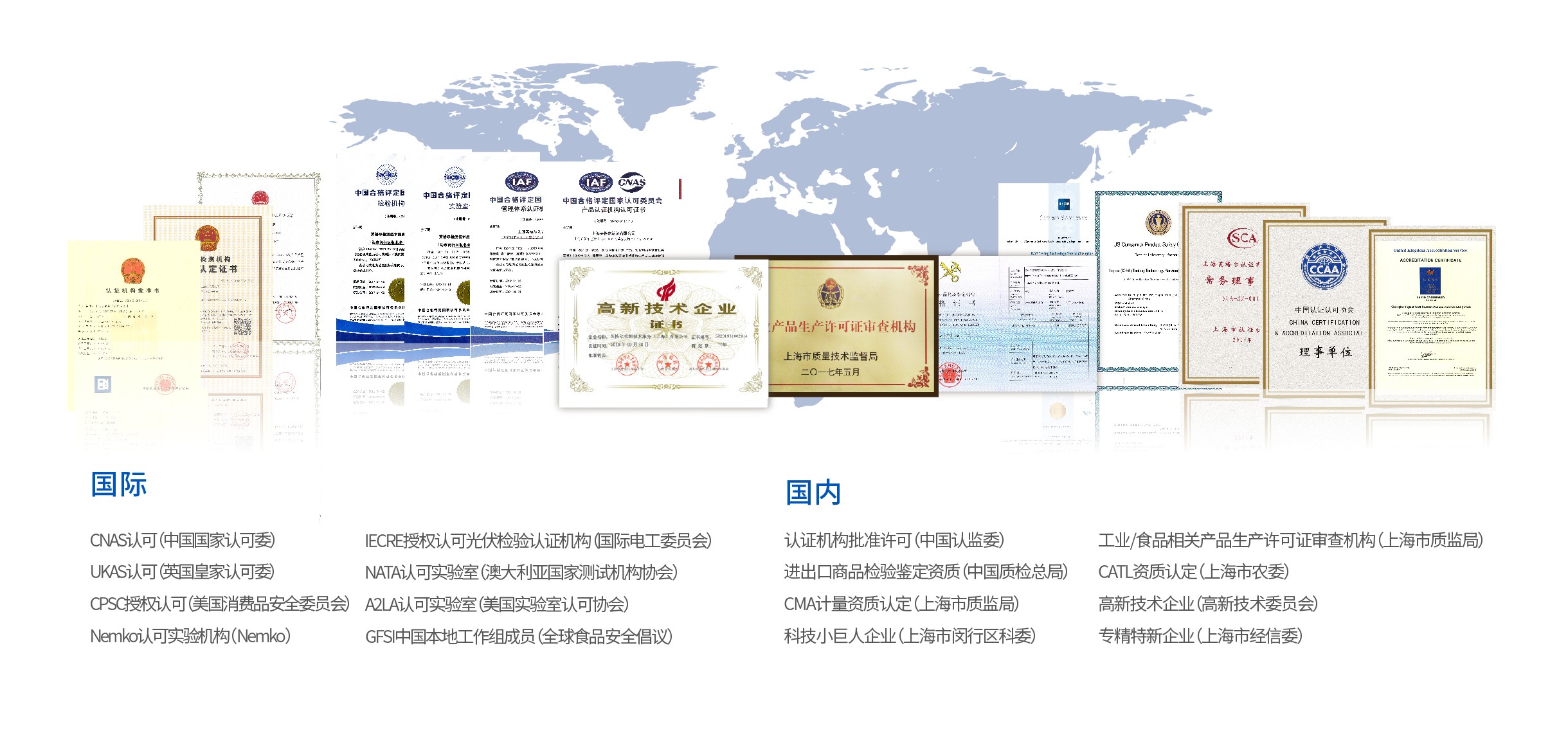
恪守全球标准规范
大型企业、政府机构、高效研发机构

一线品牌(沃特世、赛默飞、安捷伦、戴安等)高配实验室设备

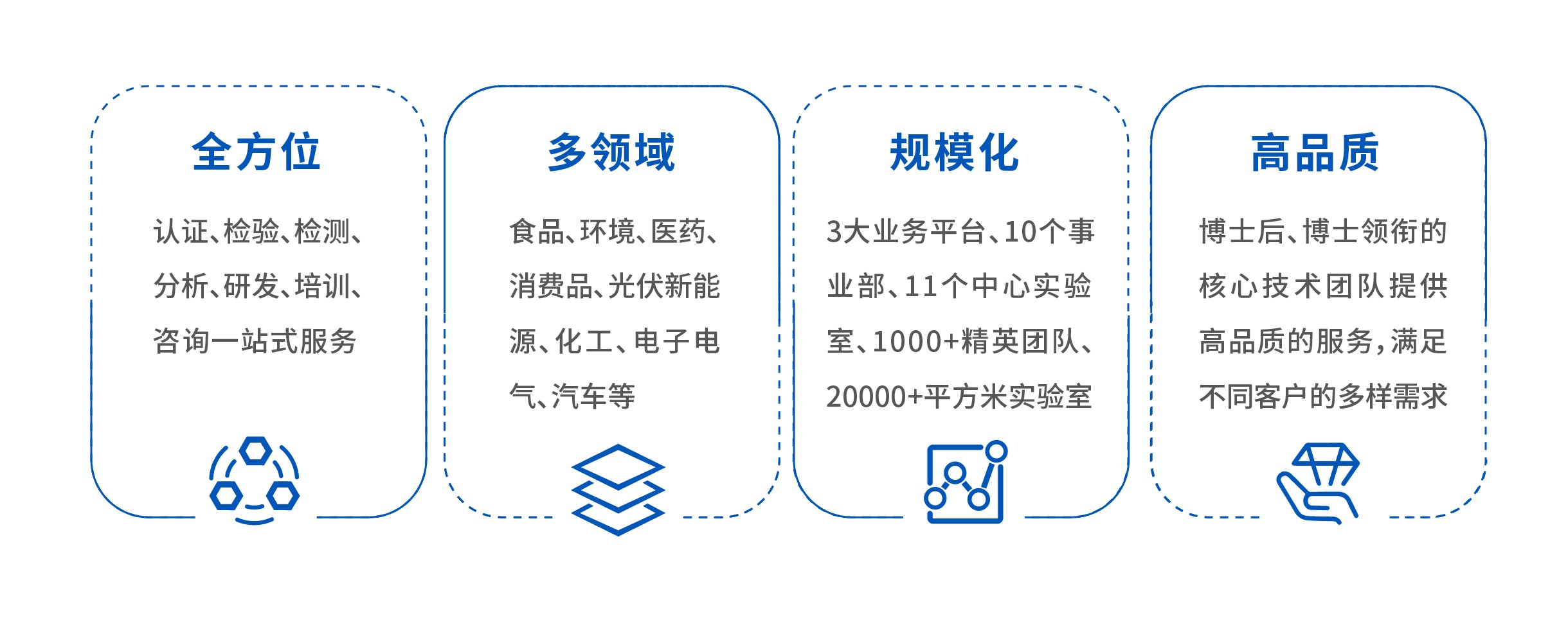
全方位的服务内容,多领域的服务能力,规模化的服务平台、高品质的服务质量
上一篇:
医疗器械 下一篇:
药物化学 






