产品留样是指制造商根据质量可追溯性或调查和产品性能研究的规定保存的材料和产品样本产品保留样本有助于在医疗器械产品质量追溯和不良事件调查中发现问题和明确事故责任,也可以为确认或修改产品技术指标提供数据支持根据北京市食品药品监督管理局发布的《医疗器械产品留样检验要点指引(2016年版)》,本文梳理了医疗器械产品留样的相关要求供参考
(一)基本要求
生产企业应根据产品和工艺的特点制定留样管理制度,明确留样目的、留样、留样比例或数量的要求,样品保留观察等,进行样品保留观察,并保留相关记录
(II)样品保留的目的
制造商应根据产品特点、工艺特点、临床应用等明确样品保留的目的样品保留的目的不同,样品数量和观察项目也会不同常见的样品保留目的如下
1对于医疗器械的质量可追溯性
制造商可以根据常见的质量问题、临床使用风险和产品特性,如无菌和物理特性,识别可追溯项目
2对于医疗器械产品原材料的质量可追溯性
对于对产品质量有关键影响的原材料,制造商可以保留原材料样品,以追溯成品质量或原材料质量的一些性能指标
3用于稳定性研究
当制造商开发新产品、新工艺或更改产品有效期等指标时,用于调查产品的稳定性
(III)保留样品
原则上应选择成品的保留样品考虑到某些医疗器械的成本、产量等因素,制造商可以结合留样目的、留样检验项目等因素,采取其他留样方法,如原材料留样和产品替代品留样留样应能代表抽样批次的产品,留样的规格型号应明确
1成品样品必须是经检验合格的产品应从成品批次中随机抽取,所有生产过程均已完成保留样品的包装形式应与市场上产品的单包装形式相同
2如果采用原材料保留样品,则应保留对产品质量有重要影响的原材料,并且原材料应能够反映成品的可追溯性能指标
3在使用产品替代品保留样品时,应考虑原材料、生产过程、生产环境、灭菌过程、产品或部件结构等因素产品替代品的形式可以是典型部件、缺陷产品、样品块等
(四)样品保存室(区)
生产企业应有相对独立、足够的样品保存室(区)用于存放样品原则上,留样的贮存条件应与相应的成品、半成品和原材料的贮存条件相一致,留样室(区)面积应与生产品种和生产规模相适应
留样室(区)应配备符合产品质量特性要求的环境监测设备,定期监测,并保存环境监测记录
(五)留样比例或数量
制造商应根据留样目的、试验项目和不同的留样,规定具体留样比例或数量保留量通常适用于保留、保留样品和测试项目保留样品的比例或数量原则上应由制造商确定,但应满足以下要求
1它可以支持至少一个质量可追溯性测试
2对于无菌产品,应为每个生产批次或灭菌批次
3保留样品因新产品、新工艺或产品有效期等指标变化而留样的,留样量单独计算,不影响质量可追溯性试验
(六)留样检验或观察
生产企业应按照留样制度定期进行留样检验或观察,并保存留样观察记录
1生产企业应根据留样目的明确样品检验或观察的频率或周期
(1)留样观察时间不应小于产品有效期
(2)稳定性研究,可以适当延长保留样品的观察时间和/或增加观察频率
(3)如果保留原材料,应考虑生产批次因素,保留样品的观察时间应确保使用该批次原材料的最后一批产品的可追溯性要求得到满足
(4)如果不影响保留样品的包装完整性,则应在储存期间至少每年对保留样品进行一次目视观察
2留样检验或观察项目
制造商应明确留样检验或观察项目、检测方法和判断标准,并具有相应的检验能力保存期内的检查或观察项目可能不同于保存期到期时的检查或观察项目
3留样记录
生产企业应当建立留样台帐,保存留样观察记录或者留样检验记录,形成留样检验报告样品观察或观察记录中应注明样品批号、观察日期、观察者、观察结果等内容留样检验报告应注明留样批号、有效期、检验日期、检验员、检验结论等
4保留样品摘要
体外诊断试剂产品保留期届满后,应汇总、分析并存档保留样品检验报告其他产品也可参照执行,以评价产品质量和检查产品质量的稳定性
5特殊项目的处理
如果在留样检查或观察过程中发现测试项目不合格,应按照相关制度进行处理,并分析不合格的原因如果该批产品将有类似的不合格,应按照不合格品或退货和召回
6等相关制度进行处理保留样品的处理
保留样品到期后,制造商应按照相关制度处理保留样品检验的剩余样品,以防止意外使用保留样品
英格尔,聚力价值信任
- 标准规范
|
- 合作伙伴
|
- 仪器设备
|
- 集团优势
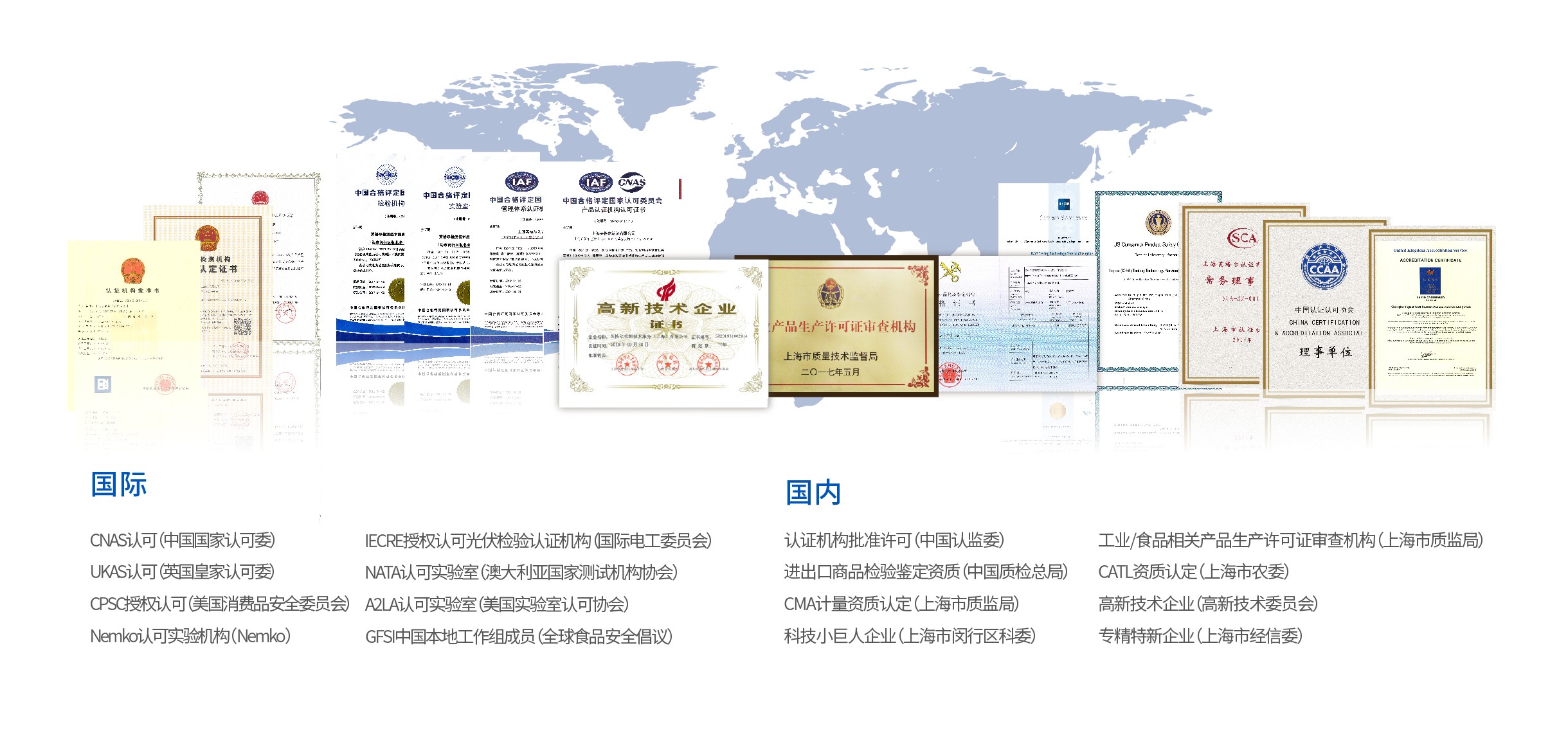
恪守全球标准规范
大型企业、政府机构、高效研发机构

一线品牌(沃特世、赛默飞、安捷伦、戴安等)高配实验室设备

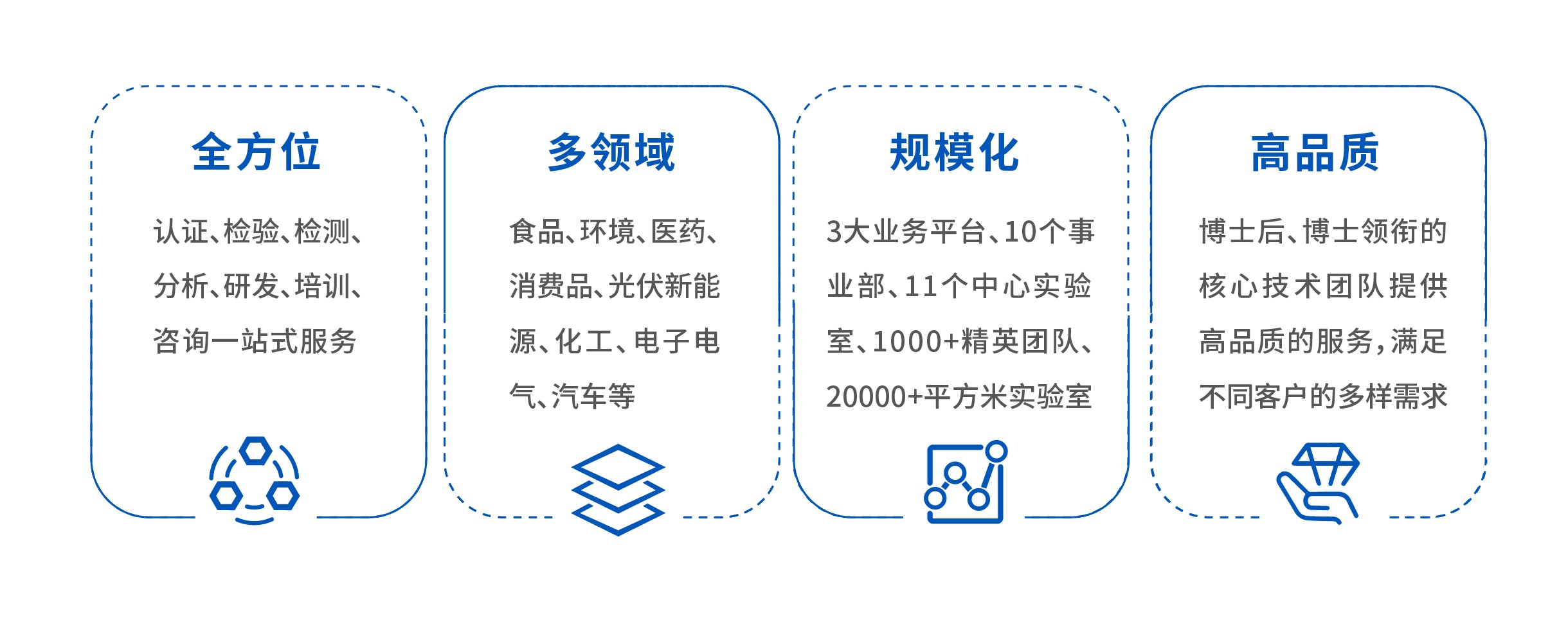
全方位的服务内容,多领域的服务能力,规模化的服务平台、高品质的服务质量
上一篇:
材料化验 下一篇:
成分表征 






